Tableau périodique des éléments
Tableau périodique des éléments : sa construction, sa périodicité, ses isotopes et radioactivités, son extension, son historique et ses usages.
Sa création revient au chimiste russe Dmitri Ivanovitch Mendeleïev et remonte à 1869. Son tableau est différent de celui qu’on utilise aujourd’hui, mais repose sur le même principe. L’objectif est également identique : proposer un rangement systématique des éléments connus afin de mettre en avant la périodicité de leurs propriétés chimiques. La table de Mendeleïev permet aussi d’identifier les éléments chimiques et de prédire certaines propriétés d’éléments qui restaient à découvrir. Jusqu’à la présentation actuelle, le tableau périodique a connu plusieurs réajustements. Pourtant, il constitue aujourd’hui un véritable outil de référence auquel se rapportent tous les comportements chimiques et physiques des éléments. La dernière mise à jour de l’UICPA de ce tableau date du 28 novembre 2016. Dès lors, la forme standard de la table comporte 118 éléments, allant de l’hydrogène à l’oganesson.Le tableau périodique standard des éléments
Ci-après la représentation la plus courante du tableau périodique des éléments. D’autres versions ont été proposées par certains chimistes. Toutefois, elles étaient limitées au domaine scientifique. Le tableau périodique standard des éléments comporte 118 éléments chimiques répartis en trois types :- 83 éléments sont dits primordiaux étant donné qu’ils disposent d’au moins un isotope stable ou suffisamment stable à un point où il est plus ancien que la Terre. À titre de rappel, les isotopes sont des atomes possédant le même nombre de protons, mais un nombre de neutrons différent. Trois des éléments primordiaux sont radioactifs, notamment l’uranium 92U, le bismuth 83Bi et le thorium 90Th.
- 11 éléments sont présents naturellement dans l’environnement terrestre et se forment continuellement par désintégration radioactive d’autres éléments chimiques tels que le thorium et l’uranium. Le plus léger d’entre eux, le technétium (43Tc), est formé par fission de l’uranium. En revanche, le plus lourd (le plutonium 94Pu) est produit par bombardement de l’uranium 238 par du deutérium. En parlant de l’uranium 238, qui est le principal isotope naturel de l’uranium, sa chaîne de désintégration crée continuellement du protactinium ainsi que du radium. Elle produit aussi du thorium 230 et 234, du radium, du radon ainsi que du polonium 210, 214 et 218. Elle produit aussi du bismuth 210 et 214, ainsi que du plomb 206, 210 et 2140. Toutefois, ces 11 éléments sont beaucoup trop radioactifs, si bien que leurs isotopes n’existent plus actuellement, alors qu’ils étaient présents lors de la formation du système solaire.
- Les 24 derniers éléments du tableau périodique sont considérés comme étant synthétiques, puisqu’ils n’existent pas naturellement sur Terre. Ils sont créés expérimentalement en laboratoire ou artificiellement dans les réacteurs nucléaires. Cependant, certains d’entre eux se trouvent dans l’environnement à la suite d’accidents nucléaires ou d’essais nucléaires atmosphériques. Certaines zones contaminées comportent par exemple de l’américium, du curium, du berkélium et du californium. Par ailleurs, il arrive que certains de ces éléments synthétiques se retrouvent naturellement ailleurs que sur Terre. De plus, leur présence aurait été détectée dans le spectre de l’étoile de Przybylski. Tel est le cas de l’einsteinium ayant été produit de manière naturelle par processus au cours d’une supernova.
Il est à noter que 103 sur 118 éléments chimiques se trouvent dans un état standard connu aux conditions normales de pression et de température. Concrètement, ces conditions fixent la température normale à 0 °C et la pression normale à 1 atm. Parmi ces 103 éléments, on compte 90 solides, 11 gazeux et 2 liquides (le brome et le mercure). Toutefois, plusieurs éléments chimiques solides ont un point de fusion avoisinant la température ambiante. Tel est le cas du francium (à 27 °C), du gallium (à 29,8 °C) et du césium (à 28,5 °C). On retrouve aussi le rubidium (à 39,3 °C) et le phosphore blanc (à 44,2 °C).
La construction du tableau périodique
Le tableau périodique est créé selon les propriétés physico-chimiques des éléments qui le composent. Toutefois, comme ces propriétés reposent sur leur configuration électrique, celle-ci est également prise en compte. Chaque ligne du tableau est dénommée « période » et correspond à une couche électronique que l’on identifie par le nombre quantique principal noté n. La numérotation de la période indique le nombre de couches électroniques existantes. Elle est numérotée de 1 à 7, car aucun élément connu jusqu’à ce jour ne comporte plus de sept couches. Par exemple, la première ligne correspondant à la première période comporte l’hydrogène et l’hélium. Les éléments d’une période sont placés de gauche à droite selon l’ordre croissant de leur numéro atomique. Tous les éléments se trouvant sur une même ligne appartiennent ainsi à une même période et ont le même nombre de couches électroniques. Par exemple, le potassium fait partie de la période 4, car il possède quatre couches électroniques. Chaque période est répartie en un à quatre blocs correspondant eux-mêmes aux sous-couches électroniques identifiées par leur nombre quantique secondaire appelé ℓ. On retrouve quatre sortes de sous-couches électroniques connues à l’état fondamental que l’on désigne par les lettres s, p, d et f. Ces dernières proviennent des abréviations employées initialement en spectroscopie. Ces sous-couches comportent respectivement 1, 3, 5 et 7 orbitales atomiques identifiables grâce à leur nombre quantique magnétique mℓ. Il est à noter que chaque orbitale atomique est occupée par au maximum deux électrons qui sont identifiés par leur nombre quantique magnétique de spins ms. Les nombres quantiques permettent de décrire un électron au sein d’un atome. Ces valeurs déterminent ainsi comment les électrons remplissent successivement les orbitales atomiques. Elles expliquent également pourquoi les éléments chimiques sont groupés dans des blocs du tableau et pourquoi tels éléments ont des propriétés similaires. Elles se distinguent en quatre types, notamment le nombre quantique :- principal n : un nombre entier naturel non nul (n ≥ 1) ;
- azimutal ℓ : un nombre entier positif ou nul vérifiant 0 ≤ ℓ ≤ n – 1 ;
- magnétique mℓ : un nombre entier vérifiant - ℓ ≤ mℓ ≤ ℓ ;
- magnétique de spin ms qui vaut – ½ ou + ½ et les électrons sont souvent représentés par les symboles ↓ et ↑.
Selon le principe d’exclusion de Pauli, deux fermions (le cas échéant, deux électrons) d’un même système (ici, l’atome) ne peuvent pas partager le même état quantique. Les sous-couches électroniques s, p, d et f peuvent comporter respectivement au plus 2, 6, 10 et 14 électrons. Ainsi, dans le tableau périodique, elles matérialisent les blocs s, p, d et f contenant chacun 2, 6, 10 et 14 éléments par période. En se basant sur la construction du tableau périodique des éléments par blocs selon les configurations électroniques, l’hélium devrait être placé au-dessus du béryllium. Dans cette colonne, les atomes de ces éléments ont une sous-couche externe ns2. Il se trouve pourtant au-dessus du néon dans la 18e colonne, dont les atomes ont une sous-couche externe np6. Ceci s’explique par le fait qu’il s’agit de la colonne des gaz nobles à laquelle l’hélium fait chimiquement partie.
Règle de Klechkowski
Les sous-couches d’une période ne font pas nécessairement partie d’une même couche électronique. Tel est le cas des éléments situés à partir de la troisième période. Ceux-ci se trouvent sur une même période, bien que leurs sous-couches appartiennent à des couches électroniques différentes. Également appelée règle de Madelung, la règle de Klechkowski dicte l’ordre de remplissage des électrons dans les sous-couches électroniques. En d’autres termes, celles-ci sont remplies de manière à ce que les valeurs n + ℓ et n soient croissantes. Quant à la distribution des électrons sur les niveaux d’énergie quantiques autour de l’atome, elle suit le principe d’Aufbau. La succession des sous-couches électroniques de chacune des périodes détermine la structure du tableau en blocs. Celles-ci sont définies par le retour d’une sous-couche s après une sous-couche p de la période précédente, avec un nombre quantique principal incrémenté d’une unité.Exceptions et règle de Hund
On constate que 80 % des 103 éléments chimiques présentent, à l’état fondamental, une configuration électronique similaire à celle déduite de la règle de Klechkowski. Il est à rappeler que l’état fondamental se définit comme l’état dont l’énergie est la plus faible. Le nombre quantique magnétique de spins des électrons participe à la détermination de cette énergie. En effet, le terme spectroscopique d’énergie la plus faible est celui dont la multiplicité de spin 2s + 1 est la plus élevée. En d’autres termes, plus le spin découlant des électrons d’une orbitale atomique est élevé, plus la configuration de ces électrons sur cette orbitale est stable. Cela fait référence à la règle de Hund. Ainsi, les éléments des blocs d et f n’ont aucun intérêt à suivre la règle de Klechkowski. Il leur est énergétiquement plus favorable de privilégier l’occupation impaire des sous-couches les plus externes lorsque la couche d ou f est entièrement remplie, vide ou semi-remplie. Cela s’explique par le fait que l’écart d’énergie entre ces sous-couches est inférieur au gain d’énergie obtenu par la redistribution des électrons. Cela engendre un nombre quantique magnétique de spins plus élevé.La périodicité des propriétés chimiques
L’intérêt même du tableau périodique est de répertorier les éléments chimiques de manière à ce que leurs propriétés physico-chimiques soient largement prédites par leur rang dans la classification. Celles-ci évoluent différemment, selon que la lecture de la table s’effectue horizontalement ou verticalement.Périodes et groupes dans la classification périodique
À titre de rappel, la période correspond à une ligne de la classification périodique des éléments. Elle se forme après remplissage progressif des sous-couches électroniques jusqu’à l’atteinte de la sous-couche s de la couche suivante. Souvent, les propriétés des éléments qui la composent changent énormément le long d’une période. Cependant, elles peuvent aussi être localement assez similaires et former des familles complètes. Tel est le cas du bloc d constitué de métaux dits « de transition » et du bloc f composé de lanthanides à la période 6 et d’actinides à la ligne 7. Si la lecture se fait à la verticale, une colonne du tableau représente un groupe. La classification périodique dispose de 18 groupes standards composés chacun de plusieurs éléments aux propriétés distinctes des groupes voisins. Au fil du temps, certains groupes se sont vus attribuer des noms d’usage. On peut citer :- les métaux alcalins (les éléments du groupe 1 appartenant au bloc s, à l’exception de l’hydrogène) ;
- les métaux alcalino-terreux (ceux du groupe 2 appartenant au bloc s) ;
- les pnictogènes (ceux du groupe 15 appartenant au bloc p) ;
- les chalcogènes (ceux du groupe 16 appartenant au bloc p) ;
- les halogènes (ceux du groupe 17 appartenant au bloc p) ;
- les gaz nobles (ceux du groupe 18 appartenant au bloc p, y compris l’hélium du bloc s).
Les termes « chalcogène » et « pnictogène » sont actuellement assez obsolètes. Toutefois, les quatre autres sont encore très utilisés et se confondent généralement avec des familles du même nom.
Groupe 1 : métaux alcalins
À part l’hydrogène, les éléments constitutifs du premier groupe de la classification périodique des éléments forment la famille des métaux alcalins. Il s’agit du lithium, du sodium, du potassium, du rubidium, du césium et du francium. Ces métaux peu denses sont de couleur argentée et disposent d’un point de fusion bas. Ils sont mous à température ambiante et forment des composés ioniques avec les halogènes. Chimiquement très réactifs, ils réagissent violemment avec l’eau et donnent des hydroxydes (des bases fortes). Cela explique le fait qu’ils ne se présentent jamais sous forme élémentaire dans le milieu naturel.Groupe 2 : métaux alcalino-terreux
Ils sont plus denses et plus durs que les métaux alcalins. Dans cette famille, on retrouve le béryllium, le magnésium, le calcium, le strontium, le baryum et le radium. Les métaux alcalino-terreux donnent également des composés ioniques avec les halogènes. Cependant, l’eau à température ambiante n’a aucun effet sur eux. Seule la vapeur d’eau déclenche la formation d’hydroxydes très basiques.Groupe 17 : halogènes
forment la famille des halogènes. Ces éléments du 17e groupe existent sous forme élémentaire diatomique. Avec l’hydrogène, ils donnent des acides forts. Avec les métaux alcalins et ceux qui sont alcalino-terreux, ils forment des composés ioniques. Ce groupe est le seul dont l’état standard des éléments peut être solide (iode), liquide (brome) ou gazeux (fluor et chlore) aux conditions normales de température et de pression.Groupe 18 : gaz nobles
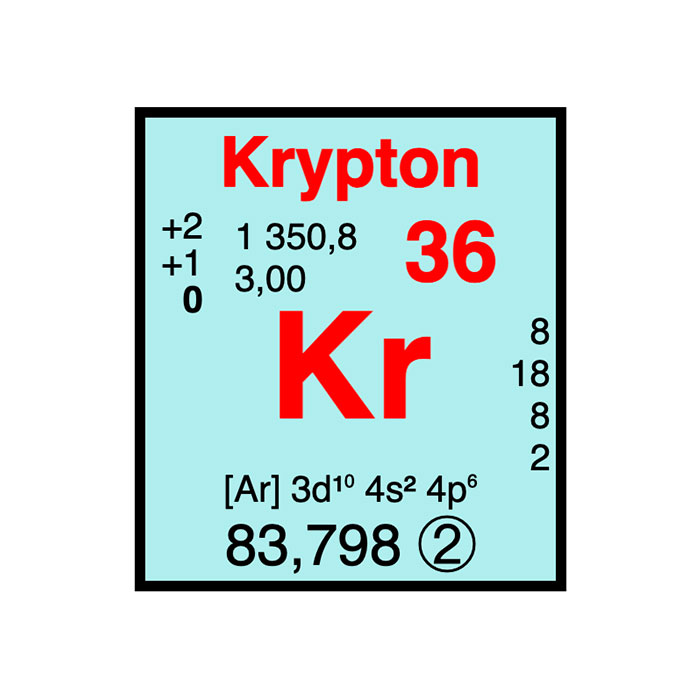
Également appelés gaz rares, ces gaz monoatomiques sont incolores et inodores. Cette famille regroupe l’hélium, le néon, l’argon, le krypton, le xénon et le radon. Ces éléments ne provoquent quasiment aucune réaction chimique aux conditions normales de pression et de température. Le groupe 3 constitue un cas particulier, car sa composition ne fait pas l’unanimité parmi les chimistes. En effet, les périodes 4 et 5 sont toujours constituées de scandium et d’yttrium. En revanche, les périodes 6 et 7 sont composées soit de lanthane et d’actinium soit de lutécium et de lawrencium. Comme ce groupe appartient au bloc d, la composition des blocs d et f est également variable selon les auteurs. La première hypothèse, incluant le lanthane et l’actinium dans le groupe 3, par conséquent dans le bloc d, dominait largement jusqu’au début du siècle. Dès lors, un renversement de tendance se fait sentir à la suite d’une convention. Comme les propriétés chimiques du scandium, de l’yttrium et des 15 lanthanides (y compris le lanthane et le lutécium) sont suffisamment semblables, ces éléments peuvent collectivement être appelés terres rares. En janvier 2021, l’Union internationale de chimie pure et appliquée ou IUPAC a proposé un compromis afin de respecter les principes généraux. Il s’agit notamment de placer le lutécium et le lawrencium dans le groupe 3.Variations des propriétés des éléments à travers le tableau
Selon la description quantique de la configuration électronique des atomes, la similitude des propriétés chimiques au sein d’un groupe s’explique par une configuration similaire des électrons dans la couche de valence. Le rayon atomique des éléments présents dans le tableau augmente de haut en bas d’un groupe, puisqu’une couche électronique s’ajoute à chaque période. Par conséquent, l’électronégativité et l’énergie d’ionisation baissent, car les électrons périphériques sont peu liés au noyau dans le bas de la table. Outre cette analyse par colonne et par ligne, le tableau périodique aide aussi à établir des relations diagonales entre certains éléments des 2e et 3e périodes situés en diagonale. Cela fait référence à la lecture du coin haut à gauche vers le bas à droite. Analyser une période vers la droite et descendre le long d’une colonne s’illustrent de manière opposée sur la couche de valence des atomes. On observe respectivement une diminution et une augmentation du rayon atomique, d’où une augmentation et une baisse de l’électronégativité. Ensuite, certaines similitudes entre quelques éléments diagonaux peuvent être relevées, bien qu’ils ne partagent ni le même groupe ni la même période. Tel est le cas de la distribution des métalloïdes dans le tableau.Rayon atomique
En général, plus on va vers la droite sur une même période du tableau, notamment des métaux alcalins aux gaz nobles, plus le rayon atomique est faible. Cette décroissance résulte du fait que la charge électrique du noyau atomique croît tout au long de chaque période. Cela augmente l’attraction du noyau sur les électrons et réduit le volume des orbitales atomiques. Ce phénomène peut être illustré par la contraction des lanthanides au cours du remplissage de la sous-couche 4f, par exemple. Concrètement, le rayon atomique de l’osmium est presque similaire à celui du ruthénium qui se trouve juste au-dessus dans la table. On peut également observer cette particularité dans la sixième période, du hafnium au platine. Après cet élément, elle est masquée par un effet relativiste dénommé effet de paire inerte. Il s’agit de la tendance des électrons dans l’orbitale s extérieure à demeurer non ionisés et non partagés aux composés des métaux du bloc p. Ce phénomène s’observe aussi avec le remplissage des sous-couches nd du bloc d. Cependant, il est moins marqué que celui relevé avec les lanthanides, même s’il a la même origine. En revanche, le rayon atomique croît lorsqu’on parcourt un groupe de haut en bas. Par ailleurs, il augmente brutalement quand on passe d’une période à une autre, particulièrement entre le gaz noble de la période p et le métal alcalin de la période p + 1. Cela s’explique par les couches électroniques formant les atomes. Ces observations jouent un rôle important dans l’élaboration et la confirmation des théories de la mécanique quantique. Ci-dessous le tableau représentant les rayons de covalence moyens mesurés pour la majorité des atomes. Ces données illustrent les tendances observées pour les rayons atomiques à travers la classification périodique des éléments.Énergie d’ionisation
L’énergie d’ionisation correspond indirectement à l’énergie de première ionisation. Cette grandeur toujours positive est l’énergie minimum nécessaire permettant de retirer un électron à un atome et de créer un cation. L’électron retiré se trouve dans la couche de valence et est donc le moins lié au noyau atomique. Par conséquent, l’énergie de deuxième ionisation correspond à celle qui est nécessaire pour retirer un deuxième électron à l’ion précédemment formé et ainsi de suite. Les énergies d’ionisation successives augmentent avec le degré d’ionisation. Par exemple, l’énergie de première ionisation du magnésium est de 738 kJ/mol-1, ce qui permet de créer le cation Mg+. L’énergie de deuxième ionisation, quant à elle, s’élève à 1 450 kJ/mol-1 en vue de former le cation Mg2+. Cette théorie conforte l’hypothèse que les électrons sont plus liés au noyau atomique qu’ils le sont dans des sous-couches intérieures. Cela explique aussi l’augmentation de l’énergie de première ionisation lorsqu’on se rapproche du haut et de la droite du tableau périodique des éléments. L’énergie d’ionisation grimpe brusquement lorsqu’on arrache un électron à une configuration électronique de gaz noble. Tel est le cas du magnésium Mg2+ dont la configuration est similaire à celle du néon. L’énergie de troisième ionisation permettant de créer le cation Mg3+ passe à 7 730 kJ/mol-1. Elle correspond à l’arrachement d’un électron de la sous-couche 2p après enlèvement des deux électrons de la sous-couche 3s lors de la première et de la deuxième ionisation. Ci-dessous un tableau représentatif de la première énergie d’ionisation mesurée pour la majorité des éléments chimiques. En visualisant les variations de cette grandeur à travers cette table, on observe plusieurs minima locaux autour de l’angle inférieur gauche des blocs. Cela fait notamment référence au césium et au francium pour le bloc s, à l’actinium pour le bloc f, au lawrencium pour le bloc d et au thallium pour le bloc p.Électronégativité
L’électronégativité est une grandeur traduisant la capacité d’un atome à attirer les électrons vers lui. Elle est déterminée par l’échelle de Pauling. Cette indication dépend à la fois du numéro atomique ainsi que de l’éloignement des électrons de valence par rapport au noyau. Un atome possédant une grande électronégativité attire fortement les électrons, et inversement. L’électronégativité se présente généralement de la même façon que l’énergie d’ionisation dans le tableau périodique : elle augmente lorsqu’on va vers le haut et vers la droite. L’élément ayant l’électronégativité la plus faible est le francium (0,7), tandis que celle possédant l’électronégativité la plus élevée est le fluor (3,98). Toutefois, quelques exceptions sont à relever, notamment celles suivant les exceptions à l’évolution du rayon atomique. On parle surtout du gallium et du germanium, dont l’électronégativité est respectivement supérieure à celle de l’aluminium et du silicium en raison de la contraction du bloc d. Placés juste après les métaux de transition, les éléments de la quatrième période ont également une électronégativité plus élevée, car leurs rayons atomiques sont moindres. Enfin, on observe une électronégativité particulièrement élevée et croissante vers le bas de la table. Tel est le cas pour les métaux nobles, les métaux du groupe du platine et le long du groupe 6.Affinité électronique
L’affinité électronique est la quantité d’énergie dégagée à la suite de l’ajout d’un électron à un atome neutre en vue de former un anion. Plus elle est grande, plus la capture d’un électron par l’atome dégage de l’énergie. Cette grandeur, généralement notée AE, A ou A, varie d’un élément chimique à un autre. Toutefois, des tendances ont été perçues à travers le tableau périodique, ce qui permet d’affirmer certaines similitudes avec l’électronégativité. L’affinité électronique des halogènes est nettement supérieure à celle des autres éléments. Celle la plus élevée est pour le chlore, à la différence de l’électronégativité dont le maximum est pour le fluor. En général, les non-métaux possèdent une affinité électronique plus positive que celle des métaux. Cependant, celle des gaz nobles n’a pas été mesurée, car ils réagissent trop peu. Le long d’une période, cette grandeur augmente d’une manière générale. En revanche, aucune tendance ne se démarque le long des groupes. En principe, elle devrait décroître d’un élément à un autre en descendant le long d’un groupe, car les couches de valence sont de moins en moins liées au noyau atomique. Pourtant, seul le groupe des métaux alcalins (groupe 1) présente une décroissance régulière de l’affinité électronique. Les expériences prouvent qu’un tiers des éléments du tableau ne suit pas cette tendance. Au contraire, ces éléments ont une affinité électronique supérieure à celui se trouvant au-dessus d’eux dans le tableau.Caractère métallique
Si on se base sur leurs propriétés chimiques et physiques générales, les éléments peuvent être classés en trois catégories : les métaux, les métalloïdes et les non-métaux. Les métaux sont souvent des solides brillants capables de créer des composés ioniques avec des non-métaux ainsi que des alliages avec d’autres métaux. Ils sont fortement conducteurs d’électricité. Les non-métaux constituent des isolants généralement gazeux, susceptibles de former des composés covalents avec d’autres non-métaux. Les métalloïdes, quant à eux, ont des propriétés intermédiaires entre les deux premières catégories. Ils se trouvent justement entre les métaux et les non-métaux dans le tableau périodique. Plus l’affinité électronique, l’électronégativité et l’énergie d’ionisation sont faibles, plus le caractère métallique de l’élément chimique se confirme. Inversement, l’élément pour lequel ces grandeurs sont élevées est non métallique. Comme la plupart des éléments ont un caractère métallique plus ou moins prononcé, les plus métalliques se regroupent autour de l’angle inférieur gauche, notamment du francium et du césium. Entre ces deux extrémités, on peut distinguer différents types de métaux :- les métaux alcalins (les plus réactifs) ;
- les métaux alcalino-terreux (plus réactifs que les métaux alcalins à un degré moindre) ;
- les lanthanides et les actinides (l’ensemble des métaux du bloc f en fait partie) ;
- les métaux de transition (y compris la plupart des métaux du bloc d) ;
- les métaux pauvres (y compris tous les métaux du bloc p).
Par ailleurs, on retrouve surtout les non-métaux autour de l’angle supérieur droit de la table, notamment du fluor et du chlore. Dans cette catégorie d’élément, on retrouve trois types de non-métaux, outre les familles conventionnelles. On peut citer les non-métaux polyatomiques qui sont similaires aux métalloïdes et susceptibles de revêtir un caractère métallique. On cite par exemple le carbone graphiste et le sélénium gris. On retrouve aussi les non-métaux diatomiques qui sont essentiellement non métalliques, sauf dans des conditions particulières. Tel est le cas de l’hydrogène métallique et de l’oxygène solide. Enfin, on cite les non-métaux monoatomiques qui sont des gaz nobles essentiellement inertes chimiquement.
Familles d’éléments chimiques et autres regroupements
Au-delà de la lecture des colonnes, des lignes et des diagonales, il est aussi possible d’interpréter le tableau selon les familles. Une famille regroupe des éléments aux propriétés physico-chimiques homogènes. On retrouve dix familles dans la classification périodique des éléments, notamment :- la famille des métaux alcalins (groupe 1, sans l’hydrogène) ;
- la famille des métaux alcalino-terreux (confondue avec le groupe 2) ;
- la famille des lanthanides (ensemble formé par les éléments du bloc f de la période 6 et le lutécium) ;
- la famille des actinides (rassemblant les éléments du bloc f de la 7e période et le lawrencium) ;
- la famille des métaux de transition (regroupant les éléments du bloc d et le copernicium, mais sans le lutécium, le lawrencium, les éléments du groupe 12 et certains éléments de la période 7) ;
- la famille des métalloïdes (éléments intermédiaires entre non-métaux et métaux) ;
- la famille des non-métaux (incluant tous les éléments non métalliques n’appartenant pas aux 17e et 18e colonnes) ;
- la famille des halogènes (comprenant les quatre premiers éléments du 17e groupe) ;
- la famille des gaz nobles (constitués des six premiers éléments du groupe 18).
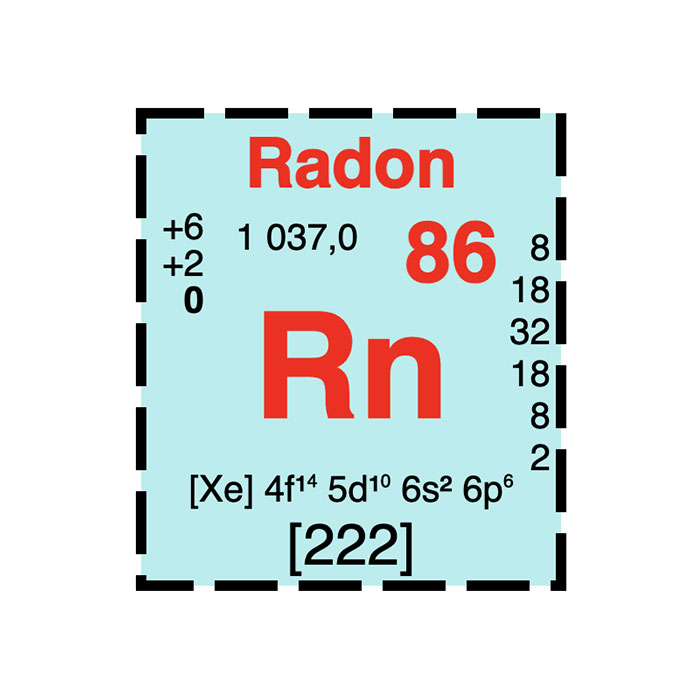
Ces familles se confondent souvent avec les groupes aux extrémités droite et gauche du tableau périodique. Au centre, elles se confondent avec les blocs et les périodes. Toutefois, ces regroupements sont imparfaits dans le sens où les propriétés chimiques et physiques des éléments varient souvent de manière plus ou moins continue. Par exemple, le béryllium fait toujours partie des métaux alcalins alors que ses oxydes sont amphotères et qu’il a tendance à former des composés covalents. Ces deux points caractérisent pourtant un métal pauvre tel que l’aluminium. Le cas du radon est aussi intéressant : il appartient toujours à la famille des gaz nobles alors qu’il n’est pas chimiquement inerte. De plus, il tend à former des composés ioniques, caractéristique permettant de le rapprocher des métaux. D’autres regroupements d’éléments existent usuellement. On peut citer, par exemple, les terres rares qui comprennent l’yttrium, les lanthanides et le scandium. On retrouve aussi le groupe du platine qui rassemble les éléments des groupes 7 à 10 des cinquième et sixième périodes. Enfin, il existe aussi la classification géochimique des éléments qui désignent les éléments lithophiles, chalcophiles, atmophiles et sidérophiles.
Limites à la périodicité aux confins du tableau
Jusqu’au milieu de la septième période, le modèle des orbitales atomiques décrit de manière satisfaisante la configuration électronique des éléments. Pour les éléments ayant un numéro atomique (Z) supérieur à 100, des effets relativistes sont significatifs sur des électrons lorsque ceux-ci sont en interaction avec un noyau fortement chargé. Il n’est plus possible d’ignorer certaines corrections provoquées par l’électrodynamique quantique. L’approximation du champ central visant à considérer les électrons de manière individuelle afin d’identifier les orbitales atomiques n’est plus valide. Des effets de couplage spin-orbite distribuent donc les niveaux d’énergie et les sous-couches électroniques. La modélisation de la distribution des électrons autour du noyau devient donc délicate pour ces éléments, et leurs propriétés chimiques deviennent plus difficiles à prévoir. Jusqu’ici, les propriétés chimiques et physiques de l’ensemble des éléments au-dessus du hassium (108Hs) sont bien connues. En revanche, seuls deux éléments ayant un numéro atomique supérieur à 108 ont été particulièrement étudiés. Il s’agit du copernicium (112Cn) et du flérovium (114Fl). De ce fait, il existe très peu d’informations sur ces éléments. Selon les études expérimentales, le copernicium s’avère un homologue plus volatil du mercure et prolonge ainsi le 12e groupe. Il est possible de le classer dans les métaux pauvres tels que le mercure, mais il peut aussi être rangé parmi les éléments de transition. Selon l’IUPAC, un élément de transition est « un élément chimique dont les atomes ont une sous-couche électronique d incomplète, ou qui peuvent former des cations dont la sous-couche électronique d est incomplète ». Cela est causé par des effets relativistes qui stabilisent la sous-couche électronique s au détriment de la sous-couche d, d’où la configuration électronique du cation Cn2+ comme suit : [Rn]5f14 6d8 7s2. Par ailleurs, le copernicium pourrait aussi être gazeux, car il revêt certaines caractéristiques des gaz nobles. Le flérovium, quant à lui, a des propriétés assez ambigües. Il est considéré davantage comme métal, plutôt que gaz noble, ce qui contredit les premiers résultats obtenus en 2008. Cet élément chimique serait également volatil, mais est plus réactif que le copernicium. Il pourrait aussi appartenir à une nouvelle famille regroupant des « métaux volatils » intermédiaires entre gaz nobles et métaux du point de vue de leurs propriétés d’adsorption sur l’or. Comme ses propriétés chimiques sont également semblables à celles du plomb, le flérovium est aussi considéré comme un métal pauvre, bien qu’il ne puisse pas être rangé dans une famille d’éléments en l’état actuel des connaissances des chercheurs. Même si l’oganesson est classé dans la 18e colonne, notamment parmi les gaz nobles, ses propriétés n’ont pas fait l’objet d’études expérimentales. Des modélisations avancent que cet élément est peut-être un solide semi-conducteur possédant des propriétés propres aux métalloïdes.Isotope et radioactivité
Le tableau périodique des éléments regroupe 80 éléments ayant des isotopes stables. En revanche, le reste des éléments est radioactif et n’en a donc pas.Isotopes
Dans le tableau périodique, les éléments chimiques sont classés selon leur numéro atomique (connu sous le symbole Z). Ce dernier représente le nombre de protons contenus dans le noyau de l’atome. Cependant, il arrive qu’il existe des atomes différents pour un même élément. Ils diffèrent les uns des autres par le nombre de neutrons dans leur noyau. On appelle « isotopes » les atomes occupant la même case dans la table. D’ailleurs, ce mot vient du grec ancien « isos » signifiant égal, et « topos » qui veut dire lieu. Il signifie donc « au même endroit ». D’une manière générale, les isotopes d’un élément possèdent les mêmes propriétés chimiques, puisque leur configuration électronique est identique. Toutefois, on relève un effet isotopique plus prononcé en raison de la masse du noyau différente. Tel est le cas de l’hydrogène 1H, de l’hélium 2He et du lithium 3Li. En parlant d’hydrogène, son isotope 2H dénommé deutérium est suffisamment différent de l’isotope 1H (protium). C’est pourquoi l’UICPA admet, sans pour autant le recommander, l’utilisation d’un symbole chimique propre au deutérium (« D »). Ce dernier est effectivement différent de celui de l’hydrogène qui est « H ».Radioactivité
Les éléments chimiques, dont le numéro atomique est compris entre 1 et 82, notamment de l’hydrogène au plomb, ont au moins un isotope stable. Le technétium et le prométhium, des éléments radioactifs, y font toutefois exception. À partir du bismuth (Z = 83), tous les éléments connus sont radioactifs. La période radioactive de l’isotope 209Bi vaut par exemple un milliard de fois l’âge de l’Univers. Quand la période va au-delà de quatre millions d’années, la radioactivité produite par ces isotopes est négligeable et présente à court terme peu de risque sanitaire. Tel est le cas de l’uranium 238 ayant une période s’élevant à environ 4,5 milliards d’années. Sa toxicité est plutôt chimique à travers certains composés peu solubles qui sont radiotoxiques (UO2 et U3O8) et des composés solubles. Concernant ces derniers, on peut citer UF6, UO2F2, UO2Cl2, UO2(NO3)2, UF4, UCl4 et UO3. Concernant les éléments ayant un numéro atomique supérieur à 110, leurs isotopes ont une période radioactive de moins de 30 secondes. Ceux des éléments se trouvant à partir de Z = 115 en ont moins d’un dixième de seconde. Le modèle en couches de la structure nucléaire aide à classer la stabilité des noyaux atomiques en fonction de leur composition en nucléons. Des études expérimentales ont permis d’observer des nombres magiques de nucléons qui confèrent aux atomes une certaine stabilité. Par exemple, le plomb (le plus lourd des noyaux stables existants) est composé des nombres magiques de 126 neutrons et de 82 protons. En extrapolation de ces résultats, certaines théories supposent l’existence d’un îlot de stabilité parmi les nucléides super lourds. Il s’agit de noyaux atomiques composés d’un nombre magique de 184 neutrons et, selon les modèles et les théories, de 114, 120, 122 ou 126 protons. Cependant, une approche plus moderne démontre par des calculs basés sur l’effet tunnel que si ces nucléides doublement magiques sont probablement stables du point de vue la fission spontanée, ils devraient pourtant subir des désintégrations α avec une période radioactive de quelques microsecondes. De plus, un îlot de stabilité relative pourrait exister autour du darmstadtium. Cela correspond aux nucléides, dont Z est compris entre 104 et 116, et N entre 176 et 186. La période radioactive des isotopes de ces éléments peut être de l’ordre de la minute.Extension du tableau périodique
Des questions se posent quant au nombre maximal de protons contenus dans un atome et au-delà de la septième période.Limite du tableau périodique des éléments
Jusqu’à ce jour, le nombre maximal d’électrons et de protons contenus dans un même atome n’est pas défini. L’observabilité pratique nous permet de l’estimer à Z = 130 au maximum dans le cas où l’existence des atomes super lourds se heurte à la limite de stabilité des noyaux. C’est pourquoi le tableau périodique des éléments se termine par l’une des valeurs suggérées par le dernier îlot de stabilité qui est centré autour de Z = 126. En 1948, le physicien américain Richard Phillips Feynman avança qu’il est impossible de représenter les orbitales atomiques quand Z > 1⁄α ≈ 137, et ce, par interprétation de l’équation de Dirac semi-relativiste. Α est la constante de structure fine. Cela rend impossible l’existence d’atomes électriquement neutres au-delà de 137 protons. Dès lors, l’élément 137 est parfois appelé « feynmanium ». Par ailleurs, le modèle de Bohr accorde aux électrons de la sous-couche 1s une vitesse supérieure à celle de la lumière si Z > 137. Une étude plus poussée prenant en compte la taille non nulle du noyau a été menée. Elle a démontré que le nombre critique de protons pour lequel l’énergie de liaison électron-noyau devient supérieure à 2m0c2 vaut Zcrit ≈ 173. Sachant que m0 est la masse au repos d’un positron ou d’un électron. Dans ce cas, si la sous-couche 1s n’est pas pleine, le champ électrostatique du noyau y crée une paire électron-positron, d’où l’émission d’un positron. Ce résultat indique donc que nous ne devons pas complètement oublier la possibilité d’observer plus tard des atomes comprenant plus de 173 protons. Quoi qu’il en soit, il met en exergue un facteur supplémentaire d’instabilité.Conjectures au-delà de la septième période
Une huitième période regroupant des éléments dotés de plus de 118 protons est envisagée, bien qu’elle soit encore inobservée jusqu’à ce jour. Elle serait la première à rassembler des éléments chimiques du bloc g qui sont caractérisés à l’état fondamental par des électrons sur une orbitale g. Toutefois, en tenant compte des limites à la périodicité aux confins du tableau, peu de chances existent pour que la configuration électronique de tels éléments suive les règles observées le long des sept périodes standards. L’établissement du nombre d’éléments contenant ce bloc g est particulièrement délicat. En effet, la méthode de Hartree-Fock en prévoit 22, tandis que la règle de Klechkowski en prédit dix. L’existence d’une neuvième période est parfois citée. Cependant, les éléments chimiques ayant un Z > 130 relèvent a priori d’une pure extrapolation mathématique étant donné l’incertitude réelle par rapport à la possibilité d’observer à terme plus d’une dizaine de nouveaux éléments sur la période 8. Il est bon de noter qu’une classification alternative des éléments a été proposée par Fricke et al. en 1971 et revue par Pekka Pyykkö en 2011. Cette variante de la table répartit les 172 éléments sur neuf périodes et les distribue de façon non périodique. Ainsi, les éléments 139 et 140 sont placés entre ceux de numéro atomique 164 et 169, dans le bloc p et non dans le bloc g. Les éléments 165 à 168 sont regroupés dans une neuvième période dans les blocs s et p.Historique
La première tentative de classification des éléments chimiques a été réalisée par Antoine Lavoisier en 1789. Pendant près de deux siècles, plusieurs hommes issus de diverses disciplines ont apporté leur contribution afin d’aboutir au tableau périodique de Glenn Seaborg qui est utilisé aujourd’hui.Première classification des éléments chimiques réalisée par Antoine Lavoisier
Le chimiste français Antoine Lavoisier a publié « Traité élémentaire de chimie, présenté dans un ordre nouveau et d’après les découvertes modernes » en 1789. Cet ouvrage réparti en deux volumes a effacé les bases de la chimie moderne en faisant le bilan des connaissances de la fin du XVIIIe siècle dans ce domaine. Il y précisa le concept d’élément chimique qui fait référence à une substance simple ne pouvant pas être décomposée en d’autres substances. Par conséquent, la loi fondamentale de conservation de la masse de chacune de ces substances simples lors des réactions chimiques a aussi été observée. Antoine Lavoisier avança également que certaines substances auparavant considérées comme simples se sont révélées être des composés chimiques. Tel est le cas de l’huile et du sel marin. Ce chimiste s’attendit donc à ce que certains minerais soient considérés sous peu comme des substances composées de nouveaux éléments. Dans cet ouvrage, Antoine Lavoisier publie un tableau récapitulatif des « substances » qui étaient auparavant considérées comme des éléments chimiques. Il créa une équivalence avec le vocabulaire utilisé par les alchimistes en vue d’éviter toute ambiguïté. Ce tableau se voulait exhaustif et servait de référence. Encore considérés comme des principes « chimiques » à cette époque, la lumière et le feu se trouvaient sur cette liste d’éléments chimiques bien qu’Antoine Lavoisier réfutait la théorie du phlogistique. La classification des éléments chimiques réalisée par Antoine Lavoisier prévoyait quatre familles :- les métaux ;
- les non-métaux ;
- les éléments impondérables, en l’occurrence les gaz et autres « essences » ;
- les « terres », notamment les minerais (sulfates et oxydes) considérés comme corps simples.
Dans son tableau, le chlore est appelé « radical muriatique » étant donné qu’Antoine Lavoisier considérait tous les acides comme oxoacides (des acides contenant de l’oxygène) et cherchait le « radical » qui aurait été rendu acide par l’oxygène (mot signifiant étymologiquement « formant des acides »). L’acide muriatique désignait donc l’acide chlorhydrique qui n’a cependant pas d’oxygène. La classification de ce chimiste fut utile pour clarifier certaines notions fondamentales. Néanmoins, elle ne prévoit encore aucune périodicité des propriétés des éléments chimiques classés. Dans ce cas, les métaux y sont simplement classés par ordre alphabétique.
Triades de Johann Döbereiner
La première tentative de classification moderne des éléments chimiques a été réalisée par Johann Wolfgang Döbereiner. En 1817, ce chimiste allemand avança que la masse atomique du strontium est identique à la moyenne arithmétique des masses atomiques du baryum et du calcium, deux éléments aux propriétés chimiques semblables. En 1829, il découvrit deux autres triades similaires, à commencer par celle des halogènes. En effet, la masse atomique du brome est égale à la moyenne arithmétique de celles de l’iode et du chlore. La deuxième est celle des métaux alcalins, car la masse atomique du sodium est égale à la moyenne arithmétique de celles du potassium et du lithium. D’autres séries d’éléments ont été découvertes par d’autres chimistes. En 1843, le chimiste allemand Leopold Gmelin mentionna des triades, puis des tétrades dans la première édition de son livre « Handbuch der Chemie ». Il prévit aussi une « pentade » regroupant l’azote, le phosphore, l’arsenic, l’antimoine et le bismuth qui composent aujourd’hui le groupe 15 du tableau périodique. Tétrades de Jean-Baptiste Dumas En 1859, Jean-Baptiste Dumas généralisa les triades de Johann Döbereiner en tétrades, et en y incluant les éléments les plus légers. Celles-ci, définies auparavant par les moyennes arithmétiques, sont désormais déterminées par une progression similaire d’une tétrade à l’autre. À titre d’exemple :- Fluor = 19 (+ 16,5) Chlore = 35,5 (+ 44,5) Brome = 80 (+ 47) Iode = 127
- Magnésium = 24 (+ 16) Calcium = 40 (+ 48) Strontium = 88 (+ 49) Baryum = 137
Même si l’approche du chimiste français Jean-Baptiste Dumas est similaire à celle de Johann Döbereiner, elle était potentiellement plus féconde. En effet, elle était applicable de manière pertinente pour de nombreux éléments. Les progressions arithmétiques se limitent à certains éléments, alors que l’incrément observé par Dumas entre les propriétés similaires et les éléments successifs mesure précisément la longueur de la période séparant ces deux éléments. On retrouve un incrément d’environ 16 entre les premiers éléments d’une tétrade, puis un autre d’environ 48 entre les deuxième et troisième éléments, et enfin entre le troisième et le quatrième.
Vis tellurique de Chancourtois
En 1858, le chimiste italien Stanislao Cannizzaro classa les éléments chimiques connus jusqu’à cette époque selon leur masse atomique. Puis, en 1862, le géologue et minéralogiste français Alexandre-Émile Béguyer de Chancourtois remarqua pour la première fois la périodicité des propriétés chimiques de ceux-ci. Il normalisa alors la masse atomique de l’ensemble des éléments en se basant sur celle de l’oxygène qui est de 16 unités. Il les organisa également en forme de spirale sur un cylindre selon l’hypothèse « les propriétés des éléments sont celles des nombres ». Ce cylindre fut divisé en 16 parties de manière à ce que les éléments aux propriétés similaires se placent l’un au-dessus de l’autre. À travers ce graphe, Alexandre-Émile Béguyer de Chancourtois observe que certaines triades et la tétrade oxygène – soufre – sélénium – tellure étaient alignées dans cette représentation. D’ailleurs, il remarqua que ces trois derniers éléments avaient des masses atomiques plus ou moins multiples de 16, notamment 32, 79 et 128. En référence au tellure (52Te), ce géologue appela cette représentation « vis tellurique » et ce fut la première esquisse de classification périodique des éléments. Toutefois, la communauté scientifique resta de marbre face à ce graphe en raison du fait que Chancourtois n’était pas chimiste. De plus, dans sa publication adressée à l’Académie des sciences, il avait utilisé des termes relevant du domaine de la géochimie qui rendait la compréhension du texte difficile. Selon l’approche conceptuelle de la démarche, ce fut une grande avancée. Cependant, sur le plan pratique, ce géologue n’avait pas détecté la bonne période pour les éléments chimiques les plus lourds. Ainsi, dans son graphe, le bore, l’aluminium et le nickel se retrouvaient sur une même colonne. Les deux premiers éléments sont corrects, mais le troisième est complètement à côté de la plaque d’un point de vue chimique.Loi des octaves de John Newlands
Un an après, en 1863, John Alexander Reina Newlands publia une classification périodique ayant eu une plus forte impression. Ce chimiste anglais organisa les premiers éléments connus par masse atomique croissante, notamment par masse équivalente croissante. Il réalise cela dans un tableau à sept lignes de manière à ce qu’une ligne regroupe des éléments aux propriétés chimiques similaires. Il plaça deux éléments dans une même case, si besoin, au lieu de laisser des cases vides. Par la même occasion, il identifia une nouvelle triade. Le silicium et l’étain furent placés aux extrémités. Par contre, l’élément médian restait à découvrir. John Newlands prédit ainsi l’existence du germanium en lui attribuant une masse atomique d’environ 73. Pourtant, il n’eut laissé aucune case vide dans son tableau de telle sorte à accueillir le germanium ou n’importe quel autre possible élément à découvrir. Son tableau était ainsi complet, bien qu’il pressentait la découverte de nouveaux éléments. Par ailleurs, ce chimiste anglais eut aussi un problème de périodicité, tout comme Chancourtois. Les éléments légers alors connus avaient une périodicité tous les sept éléments, mais cela s’arrêtait jusqu’au calcium. Au-delà de ce dernier élément, le tableau de John Newlands est inefficace. La mise en exergue d’une périodicité jusqu’au calcium est déjà, elle aussi, une grande avancée. Ce chimiste anglais appela sa représentation la « loi des octaves » par analogie avec les sept notes de musique. Pourtant, ses confrères de la Société de chimie de Londres se moquèrent de lui et considérèrent cette classification comme ridicule. La qualité de cette analyse n’a été reconnue qu’après la publication des travaux de Dmitri Ivanovitch MendeleïevNotation d’éléments manquants par William Odling
Dans les années soixante, le chimiste britannique William Odling travaillait également sur une classification périodique étonnamment proche de celle publiée par Mendeleïev en 1869. Il organisa les éléments chimiques alors connus en périodes verticales et laissa des cases vides pour les éléments manquants. À la différence du premier tableau de Mendeleïev, le platine, le mercure, le thallium et le plomb furent placés dans les bons groupes. Étant un rival de John Newlands, son action entacha toutefois sa réputation et sa contribution à la création du tableau périodique des éléments est passée inaperçue.Introduction de la valence avec Lothar Meyer
La contribution du médecin et chimiste allemand Julius Lothar Meyer est à peine mieux reconnue que celle de William Odling. Ses travaux furent effectivement publiés après ceux de Mendeleïev alors que la plupart d’entre eux étaient antérieurs. En effet, il publia sa première classification des éléments en 1864, puis peaufina une deuxième version en 1868 qui ne fut totalement publiée qu’en 1895. Lothar Meyer publia donc un premier tableau comprenant 28 éléments rangés en six familles organisées par valence. Ce fut un grand pas vers la forme moderne de la classification périodique. Celle-ci est organisée en groupes selon la configuration électronique des éléments, elle-même en relation avec la valence de ceux-ci. Cependant, les deux tableaux diffèrent sur plusieurs points. Par exemple, les éléments chimiques étaient toujours classés par masse atomique croissante. Le second tableau de Lothar Meyer – corrigeant et élargissant le premier – fut publié en 1870, quelques mois après la classification de Mendeleïev. Il renforça l’impact de celle-ci sur la communauté scientifique en apportant aux thèses du chimiste russe, encore fortement contestées, le soutien des travaux indépendants. Ce tableau gagnait des points sur deux plans : la longueur variable des périodes et la disposition des éléments de manière à éviter les regroupements pas terribles de John Newlands. Tel est le cas du fer, de l’or et de certains éléments du groupe du platine. Lothar Meyer eut également l’idée de tracer une courbe représentative des éléments avec leur masse atomique en abscisse et leur volume atomique en ordonnée. La courbe présente alors une série de minima et de maxima périodiques. Les maxima correspondent aux éléments chimiques les plus électropositifs.Classification périodique de Mendeleïev
Bien que plusieurs travaux se soient succédé, on doit le tout premier tableau périodique des éléments à Dmitri Ivanovitch Mendeleïev. Celui-ci se rapproche de celui qu’on utilise aujourd’hui, que ce soit au niveau de la forme ou de la vision qui l’accompagne. En effet, contrairement à ses prédécesseurs, ce chimiste russe a formellement expliqué en quoi sa classification constituait un véritable outil d’analyse théorique des propriétés de la matière. Il formula cela sur huit points précis :- Lorsqu’on range les éléments par masse atomique croissante, on observe une périodicité de leurs propriétés chimiques.
- Les éléments ayant des propriétés chimiques similaires peuvent avoir des masses atomiques semblables. Tel est le cas de l’osmium, de l’iridium et du platine. Toutefois, ils peuvent aussi avoir des masses atomiques croissantes de manière arithmétique, comme le cas du potassium, du rubidium et du césium.
- Le rangement des éléments ou des groupes d’éléments par masse atomique croissante correspond à leur valence et est, dans certaines mesures, lié avec leurs propriétés chimiques.
- Les éléments chimiques les plus abondants dans le milieu naturel sont ceux ayant la plus faible masse atomique.
- La valeur de la masse atomique fixe les propriétés des éléments chimiques.
- La masse atomique de certains éléments devrait être revue de temps en temps, et ce, sans prendre en considération leur masse atomique expérimentale. En effet, le tableau gagne en cohérence si certains éléments, en l’occurrence le tellure, étaient réorganisés.
- D’autres éléments pourront être découverts et ajoutés au tableau au moment de sa publication. Tel est le cas de ceux qui sont semblables à l’aluminium et au silicium ayant une masse atomique comprise entre 65 et 75.
- Certaines propriétés des éléments chimiques peuvent être prédites sur la base de leur masse atomique.
La publication du tableau de Mendeleïev a réalisé une avancée significative dans le domaine. Ce chimiste russe prédit ainsi l’existence d’une série d’éléments chimiques dont il mentionna certaines propriétés. On cite :
- l’eka-bore (44) qui correspond au scandium (45) – élément découvert en 1879 ;
- l’eka-aluminium (68) qui correspond au gallium (69,7) – élément découvert en 1875 ;
- l’eka-silicium (72) qui correspond au germanium (72,6) – élément découvert en 1886 ;
- l’eka-manganèse (100) qui correspond au technétium (99) – élément découvert en 1937.
La prédiction de l’eka-aluminium fut particulièrement brillante, puisque Mendeleïev avait prévu une densité de 6 g/cm3 et un point de fusion bas. Les valeurs réelles sont 5,9 g/cm3 et 29,78 °C. Les prédictions de ce chimiste russe se confirmaient également lors de la découverte du germanium. Les données étaient parfaitement en accord avec ses observations et les propriétés physico-chimiques qu’il avait prévues. Par sa théorie, Mendeleïev identifia une dizaine d’éléments bien que leur masse atomique fut déterminée de manière incorrecte. Par ailleurs, sans le savoir, il réorganisa certains éléments chimiques selon leur numéro atomique, et non leur masse atomique. Les travaux de Mendeleïev n’ont pas fait l’unanimité auprès de ses pairs. Toutefois, la publication subséquente et indépendante de nombreux résultats similaires a penché la balance en faveur de cette nouvelle vision des éléments chimiques. On parle surtout des travaux de John Newlands et de Lothar Meyer.