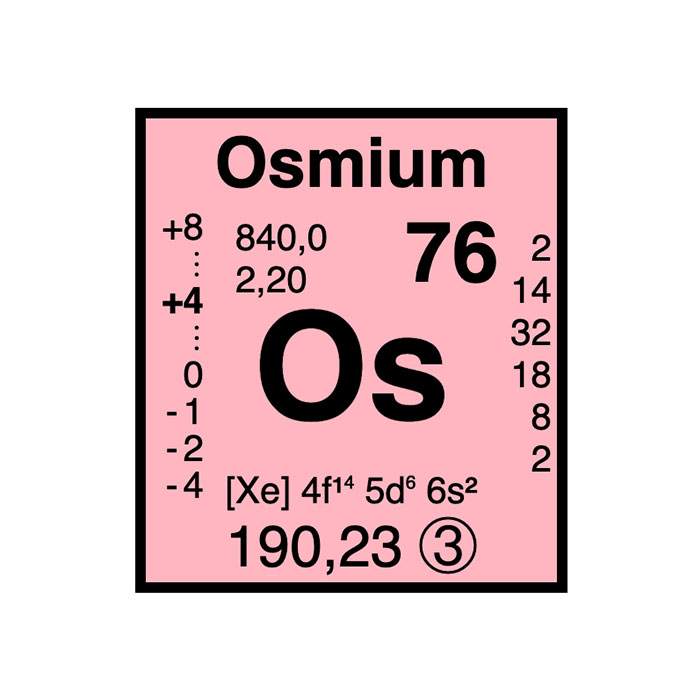
Caractéristiques du corps simple
Le corps simple de l’osmium prend la forme d’un métal dense, cassant et d’un gris bleuté brillant, même à haute température. Il a un point de fusion élevé et est très résistant à la déformation. Produire cet élément est très difficile. On l’obtient plus facilement sous forme de poudre. Cependant, elle est extrêmement toxique. Elle réagit rapidement avec l’oxygène de l’air pour former du tétraoxyde d’osmium OsO4. Ce puissant composé oxydant est dangereux pour la santé.
L’osmium est le corps simple naturel le plus dense, ce qui le place juste devant l’iridium. Il est également moins fusible que ce dernier. En outre, il a la plus haute température de fusion et la plus faible pression de vapeur de tous les métaux du groupe du platine.
Cet élément doit être manipulé avec précaution. Comme le tétraoxyde d’osmium OsO4 est un composé toxique, il peut causer des dommages importants aux yeux, à la peau et aux voies respiratoires. Ceux qui le travaillent doivent porter des équipements de protection individuelle pour éviter tout contact avec ce produit dangereux.
Chimie et composés typiques de combinaison
L’osmium présente plusieurs états d’oxydation, allant de +1 à +8, mais les plus courants sont +4 et +3. Le tétroxyde d’osmium OsO4 se forme par chauffage à 200 °C sous balayage de gaz oxygène. Il peut être réduit par le carbone ou le gaz hydrogène. Ce processus permet de produire de l’osmium métallique pulvérulent.
Un ancien procédé permet d’obtenir cet élément sous forme compact à partir du disulfure. Pour ce faire, il faut le faire réagir avec de l’ammoniaque et du sulfhydrate d’ammoniaque. Le produit obtenu est ensuite mis à sécher à l’air libre avant d’être chauffé dans un creuset en charbon.
Cet élément peut se combiner avec le soufre et les semi-métaux tels que le phosphore, l’arsenic, l’antimoine, le sélénium et le tellure. Il en résulte des composés tels que le sulfure d’osmium, le séléniure d’osmium et le tellurure d’osmium. En réagissant avec les halogènes à chaud, il donne naissance à différents composés tels que les fluorures, les chlorures, les bromures et les iodures d’osmium. Les niveaux de valence tendent à s’abaisser lorsque l’ion halogénure est plus polaire et l’halogène moins électronégatif.
Ce platinoïde peut former des complexes avec différents ligands tels que le cyclopentadiène et le monoxyde de carbone (osmium carbonyle). Ces complexes servent de catalyseurs dans des réactions chimiques complexes.
Applications de l’osmium
La rareté et le coût relativement élevé de l’osmium limitent ses applications industrielles. Ses propriétés physiques et chimiques uniques le rendent utile dans plusieurs domaines.
L’une des principales utilisations de cet élément chimique est la fabrication de pointes de stylo. La présence de cet élément les rend durables et résistants à l’usure.
Ce platinoïde entre dans la fabrication de contacts électriques et d’instruments chirurgicaux. En médecine, l’osmium est inclus dans le traitement de certaines formes de cancer, notamment le cancer du poumon et le cancer de la prostate. Il entre dans la composition de certains traitements de la maladie d’Alzheimer.
Coûts
L’osmium est l’un des métaux les plus chers du monde. Son coût varie en fonction de la demande du marché, de sa qualité et de ses frais de production. En 2014, son prix moyen sous sa forme pure à 99 % était de 86,4 euros par gramme.
Utilisation commerciale
La marque horlogère Hublot a créé une montre appelée Fusion tourbillon Firmament en 2014 dont le cadran est en cristaux d’osmium. Ceux-ci sont obtenus par la cristallisation de la poudre du platinoïde sous atmosphère de chlore, par dépôt chimique en phase vapeur. Cette technique permet d’atteindre le point de fusion élevé de cet élément chimique. Elle modifie sa structure cristallographique pour créer des cristaux dont la taille maximale ne dépasse pas quelques millimètres. Les cristaux d’osmium ont des reflets bleutés et sont inaltérables à l’air.
On fait aussi appel à cette technique de cristallisation de l’osmium dans la fabrication des pièces de bijouterie. Ce platinoïde est très apprécié dans ce domaine pour sa couleur et son éclat ainsi que pour sa résistance à la corrosion et à l’usure. Ces pièces sont souvent très coûteuses.
Toxicologie et écotoxicité
L’osmium sous sa forme métallique n’est pas toxique pour l’être humain. Cependant, sa poudre est pyrophorique. Elle réagit avec l’oxygène à température ambiante pour former du tétroxyde d’osmium volatil. Cette substance est extrêmement dangereuse pour l’Homme. Certains composés peuvent également être convertis en tétroxyde si de l’oxygène est présent. Ce dernier constitue la principale source de contact avec l’environnement. Des concentrations de l’ordre de 10−7 g/m3de ce produit dans l’air provoquent des atteintes graves au système respiratoire. Le tétroxyde d’osmium volatil a un effet corrosif sur la peau et les yeux.
On retrouve ce platinoïde dans les structures internes des pots catalytiques. La corrosion, les vibrations et les chocs thermiques auxquels sont soumis ces derniers entraînent la libération de métaux catalytiques. Ceux-ci sont expulsés avec les gaz d’échappement. Ils se mélangent à l’air des grandes villes et sont aéroportés jusque dans les glaces de l’Arctique. Des études effectuées entre 1988 et 1998 ont montré une augmentation régulière des teneurs de ces métaux dans l’air ambiant. Ces analyses révèlent que cette hausse résulte de l’apparition des pots catalytiques automobiles en 1988.
L’osmium fait partie des impuretés présentes dans les platinoïdes catalytiques. Une faible quantité de cet élément est perdue sous forme particulaire. Il est rejeté dans l’air avec les gaz d’échappement et se dépose sur les routes. La partie la plus importante s’évapore sous forme gazeuse. En laboratoire, la volatilité de ce platinoïde sous forme de tétroxyde d’osmium est élevée. Près de 95 % du minerai des pots catalytiques se vaporise et se disperse dans l’air. Les automobiles contemporaines constituent alors la première source majeure, et ce, à l’échelle planétaire, de pollution en osmium non radiogénique. Ces dépôts sont importants comparés à ceux des poussières d’origine naturelle. Ce métal n’est pas biodégradable et s’ajoute à la liste des rares autres sources anthropiques déjà répertoriées. Il est retrouvé en quantité significative dans les eaux et dans les sédiments.
Risques
Le temps moyen de vie de l’osmium dans l’air ou dans l’eau reste inconnu à ce jour. Comme il s’agit d’une molécule très réactive, les scientifiques supposent que sa forme vapeur a une durée de vie relativement faible. Son cycle dans les compartiments vivants des écosystèmes n’est pas connu, malgré qu’une accumulation dans les sédiments ait déjà été mesurée. Une étude isotopique a été menée récemment et a démontré que cette contamination était planétaire. De l’osmium anthropogénique a été retrouvé dans les neiges, les eaux de pluie et les eaux marines superficielles. En usage normal, on estime que 100 % de cet élément présent dans le catalyseur des pots d’échappement des voitures est perdu dans l’air. En effet, lorsque ces catalyseurs sont chauffés à des températures élevées, une grande partie de l’osmium qu’ils contiennent se transforme en vapeur. Il s’agit du OsO4, la forme gazeuse de l’osmium. Ce phénomène a des conséquences environnementales de grande ampleur, car l’osmium est facilement dispersé par les précipitations (pluie, neige) et les eaux de surface.