Propriétés physiques de l’astate
Les propriétés physiques de l’astate ont principalement été évaluées à l’aide de méthodes théoriques ou semi-empiriques. Chez les halogènes, plus ils sont lourds, plus leur couleur s’assombrit : violet-gris sombre pour l’iode, brun-rouge pour le brome, vert-jaune pour le chlore et incolore pour le fluor. En se basant sur cette propriété, en tant que métalloïde, l’astate pourrait être un solide de couleur noire.
En tant que métal, l’astate aurait une apparence métallique. Toujours chez les halogènes, les points d’ébullition et de fusion augmentent avec le numéro atomique. Selon ces estimations, celles de l’astate seraient respectivement de 610 et de 575 K (soit 337 et 302 °C). Toutefois, des études expérimentales ont donné des valeurs inférieures, avec une température d’ébullition de 503 K pour l’astate diatomique.
La pression de vapeur de l’At est inférieure à celle de l’iode, impliquant ainsi qu’il se sublime moins vite également. Malgré cela, la moitié d’une quantité donnée d’astate se volatiserait en une heure, à température ambiante, si elle est déposée sur une surface en verre propre.
Les raies d’absorption dans la région des ultraviolets moyens du spectre de l’astate révèlent des transitions électroniques entre les orbitales 6p et 7s.
La structure solide de l’astate demeure encore inconnue. Étant à la fois analogue de l’iode et halogène, il serait doté une structure cristalline orthorhombique. Cette structure serait composée de molécules d’At diatomique, qui lui conférerait une propriété de semi-conducteur avec une bande interdite de 0,7eV. Toutefois, sous une forme condensée, il réagit plus comme un métal. Éventuellement, il adopterait une cristallisation dans un système cubique à faces centrées. Dans cet état, l’astate pourrait même manifester des propriétés supraconductrices, tout comme l’iode qui adopte une telle phase sous haute pression.
Les résultats expérimentaux qui prouvent l’existence de l’astate diatomique (At2) sont rares et non concluants. En effet, les affirmations sur sa présence sont contradictoires. Malgré cette controverse, plusieurs caractéristiques de l’At diatomique ont été prédites :
- une chaleur latente de vaporisation (∆Hvap) d’environ 54,39 kJ mol−1,
- une énergie de dissociation d’environ 83,7 ± 12,5 kJ mol−1,
- une longueur de liaison estimée à environ 300 ± 10 pm.
La valeur de sa chaleur latente de vaporisation suppose qu’à l’état liquide, l’astate serait métallique. En effet, tous les éléments dont cette valeur est supérieure à environ 42 kJ mol−1 le sont dans cet état.
Propriétés chimiques de l’astate
La compréhension de la chimie de l’astate n’est pas facile, car les concentrations utilisées en expérience sont très faibles, sans compter les éventuelles réactions avec les sous-produits radioactifs, les filtres, les parois ou les impuretés.
Dans des solutions très diluées, les propriétés chimiques de l’astate sont apparentes même si sa concentration est très basse, inférieure à 10-10 mol/L (correspondant à une activité d’environ 1,6 GBq/L). Des propriétés similaires à celles des autres halogènes sont constatées, comme la formation d’anions. Par ailleurs, l’At a des caractéristiques métalliques qui se manifestent par :
- sa capacité à se déposer sur une cathode et à former des précipités avec d’autres sulfures métalliques dans l’acide chlorhydrique,
- sa formation d’un cation monoatomique stable en solution aqueuse,
- son aptitude à former des complexes avec l’EDTA, un agent chélatant,
- sa réactivité similaire à celle d’un métal lors du marquage d’anticorps.
Quand il est à son état d’oxydation +I, l’astate est semblable à l’argent. Cependant, dans l’ensemble, il est similaire à l’iode et est capable de former des liaisons halogènes plus facilement que ce dernier.
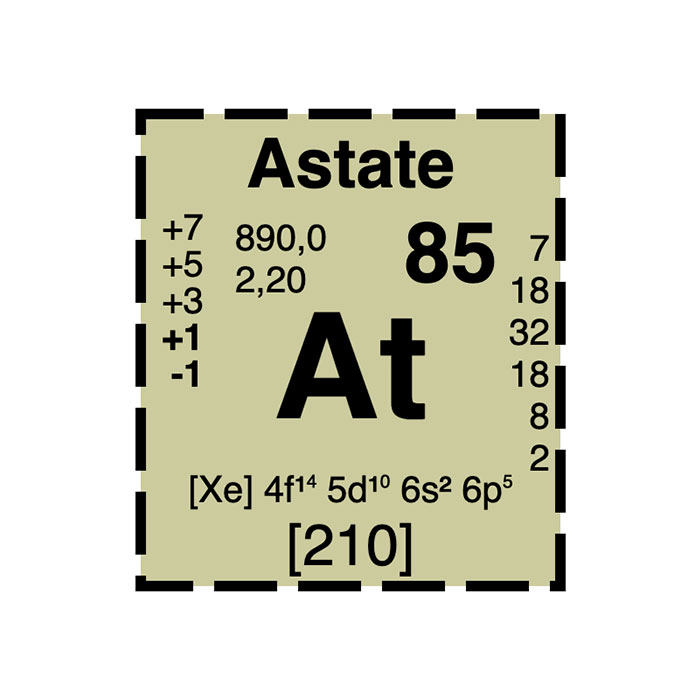
Concernant ses propriétés électronégatives, l’At a une valeur de 2,2 sur l’échelle révisée de Pauling. Cette valeur est inférieure à celle de l’iode mais égale à celle de l’hydrogène. Dans le complexe HAt (astature d’hydrogène), on suppose que l’ion est supporté par l’hydrogène. Par conséquent, ce composé devrait plutôt être appelé hydrogénure d’astate, ce qui est en adéquation avec la valeur de l’électronégativité de 1,9 sur l’échelle d’Allred-Rochow (inférieure à celle de hydrogène 2,2).
En 2011, il a été supposé que l’affinité électronique de l’astate serait environ un tiers inférieure à celle du chlore. Ce dernier possède la plus grande affinité électronique parmi les halogènes, en raison des interactions spin-orbite. Cette prédiction a été confirmée en 2020, avec une valeur d’affinité électronique évaluée à 233 kJ/mol.
Les composés de l’astate
L’astate présente une réactivité inférieure à celle de l’iode qui est déjà le moins réactif parmi les autres halogènes. En raison de sa désintégration radioactive, seules de très petites quantités de ses composés ont pu être synthétisées et étudiées. Les réactions ont principalement été examinées en utilisant des solutions d’astate réduites mélangées à des proportions plus importantes d’iode. Cette approche permet de garantir une quantité de matière suffisante pour réaliser les techniques de laboratoire courantes telles que la précipitation ou la filtration.
L’astate peut adopter différents niveaux d’oxydation allant de -1 à +7 en nombre impair, tout comme l’iode. Des composés de l’astate avec l’hydrogène, les métaux, les alcalins et les chalcogènes sont également connus.
Composés avec les métaux
Les composés associés à l’At sont rares. Parmi ceux qui ont été identifiés peuvent être cités l’astature de plomb, de thallium, d’argent, de palladium et de sodium. À partir de l’observation des halogénures d’autres métaux, les caractéristiques des astatures d’argent et de sodium, ainsi que celles d’autres astatures d’éléments alcalins et alcalino-terreux, ont pu être évaluées.
Composés avec l’hydrogène
Les précurseurs de la chimie de l’astate ont observé que l’acidification de l’At par l’acide nitrique dilué provoque la formation d’un composé d’astate et d’hydrogène, couramment nommé astature d’hydrogène. Le nom d’hydrogénure d’astate est plus approprié pour ce composé qui s’oxyde très vite. Dans la réaction, un cation At0 ou At+ se forme. Si on ajoute l’argent (I), la précipitation en astature d’argent (AgAt) ne se fera qu’en partie. En revanche, l’iode ne sera pas oxydé et on assistera à la formation d’un iodure d’argent(I).
Composés avec l’oxygène et les oxyanions
Dans une solution aqueuse d’acide perchlorique, les ions AtO– et AtO+ ont été formés en faisant réagir l’astate avec des oxydants tels que le persulfate de sodium ou le brome élémentaire. Initialement identifié comme AtO2–, le composé est en fait du AtO(OH)2–, un produit de l’hydrolyse de AtO+ (tout comme l’est l’AtOOH). L’oxydation de l’astate avec l’hypochlorite de potassium en présence d’hydroxyde de potassium engendre l’anion AtO3.
Dans une solution chaude de Na2S2O8, l’oxydation de l’astate entraîne la formation du triastatate de lanthane, La(AtO3)3. La poursuite de l’oxydation de l’AtO3–, avec du difluorure de xénon en solution basique à chaud ou avec du periodate en solution neutre ou basique, provoque la formation de l’ion perastatate, AtO4–. Ce dernier est stable seulement à un pH égal ou supérieur à 7.
L’astate pourrait également former des cations dans des sels qui contiennent des oxyanions tels que le dichromate ou l’iodate. En solution acide, il se précipite avec des sels insolubles de cations métalliques comme le dichromate de thallium(I) ou l’iodate d’argent(I). Il adopte alors un état d’oxydation positif monovalent ou intermédiaire.
Composés avec les autres chalcogènes
On peut avoir une réaction de l’astate avec les autres chalcogènes. La combinaison du soufre et de l’At donne des composés tels que l’At(CSN)2− et le S7At+. Avec le tellure, il forme un colloïde d’astate-tellure et avec le sélénium, on obtient un complexe de coordination sélénourée.
Réactions avec les halogènes légers
L’astate entre en réaction avec le chlore à l’état gazeux, le brome, l’iode et produit des composés interhalogènes : AtCl, AtBr et AtI. Dans une solution aqueuse d’iode / iodure, on obtient également l’AtI. Une solution d’iode/monobromure d’iode/bromure permet également d’obtenir de l’AtBr. Quand le bromure ou l’iodure est en excès, il se produit une formation d’ions AtBr2− ou AtI2−.
Dans une solution de chlorure, les composés AtCl2− ou AtBrCl− peuvent se précipiter dans les réactions d’équilibre. En présence de chlorures, une molécule mal connue, apparemment de l’AtOCl ou de l’AtCl, résulte de l’oxydation de l’astate par du dichromate.
Des complexes tels que l’AtCl2− ou l’AtOCl2− peuvent également être produits. Certains polyhalogénures, tels que PbAtI, TlAtI2, CsAtI2 et PdAtI2 ont été obtenus par précipitation, ou supposés l’avoir été.
Réactions dans un spectromètre de masse à plasma sources d’ions
Dans un spectromètre de masse à plasma, la formation des ions [AtCl]+, [AtI]+ et [AtBr]+ a été observée. L’opération a été réalisée en mettant une cellule remplie d’hélium contenant de l’astate en présence de vapeurs d’halogènes plus légers. Cette observation sous-entend que des molécules neutres stables sont présentes dans le plasma ionisé.
Jusqu’à présent, aucun fluorure d’astate n’a été découvert, peut-être en raison de leur grande réactivité. Il est possible que le composé fluoré initialement obtenu réagisse avec les parois en verre du récipient, ce qui empêcherait la formation d’un produit volatil. La synthèse d’un fluorure d’astate pourrait nécessiter l’utilisation d’un solvant liquide de fluorure d’halogène. Ce solvant serait similaire à celui employé pour la caractérisation du fluorure de radon.
Autres composés
L’astate est capable d’établir des liaisons avec l’azote, le carbone et le bore. Divers composés du bore ont été élaborés avec des liaisons At-B, qui sont plus stables que les liaisons At-C.
Dans un cycle benzénique, l’astate peut se substituer à un atome d’hydrogène pour produire de l’astatobenzène, C6H5At. Sous l’effet du chlore, ce dernier s’oxyde en C6H5AtCl2, lequel donne du C6H5AtO2 quand il est plongé dans une solution basique d’hypochlorite.
Dans le perchlorate de dipyridine-astate(I) [At(C5H5N)2][ClO4] et son analogue nitrate, l’atome d’astate s’associe avec chaque atome d’azote des deux anneaux pyridine.