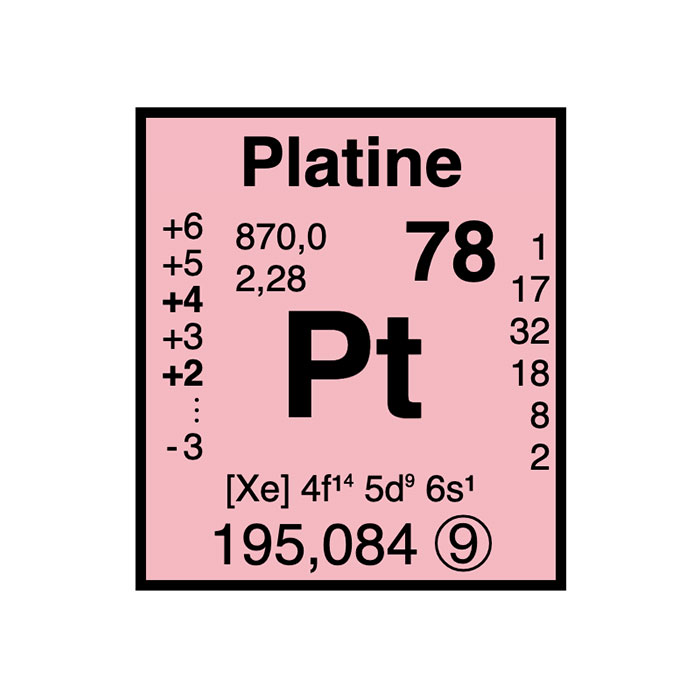
Les effets toxiques du platine dans le monde
Entre 1993 et 1996, plusieurs analyses d’échantillon d’air et d’urine sont effectuées à Munich. Ceux-ci ont permis d’obtenir les résultats suivants :
- une forte augmentation (triplée) de teneurs en air du platine allant jusqu’à 62 pg/m3 (7,3 ± 6,5 pg/m3 en 1993-1994 à 21,5 ± 13,8 pg/m3 en 1995-1996) ;
- un taux moyen de platine dans l’urine de 6,5 ng/g de créatinine.
96 % des personnes testées avaient moins de 20 ng/g de créatinine et les 4 % présentaient 4 fois plus (contaminés par les alliages dentaires or-platine qu’ils portaient).
À Mexico, le platine est en quantité croissante à cause des poussières dans les zones de circulation des véhicules qui sont équipés de pots catalytiques. En Italie (sol de Naples), le taux de platine peut aller jusqu’à 52 μg/kg contre 110 μg/kg pour le palladium alors que la norme est de 6,2 μg/kg pour le platine et 17,2 μg/kg pour le palladium. À Boston, le taux de platinoïdes et notamment les particules PM10 inhalées par la population est en hausse.
La hausse du taux de ces métalloïdes est le résultat des circulations intenses. En effet, la cartographie de la pollution est inter reliée à celle de la densité de la circulation et du réseau routier. Les pots d’échappement catalytiques sont à l’origine de la croissance des valeurs du platine. Depuis 1993, les proportions respectives de platinoïdes (Pt/Pd/Rh) dans les pots catalytiques suivent des normes strictes.
Les lieux les plus susceptibles d’être contaminés par le platinoïde
Voici les endroits les plus intoxiqués en platinoïdes :
- Les tunnels : ils contiennent de petites particules (PM10) et très petites (PM 2,5). Les PM10 qui représentent les 70 % des particules ne peuvent passer dans les organes humains. En revanche, les PM 2.5 qui représentent 22 % passent dans le sang et d’autres organes.
- Les sédiments de lacs et rivières : ils renferment des platinoïdes en quantité comme dans le lac proche de Boston. Ces couches de sédiment ont nettement augmenté son taux de platinoïdes depuis l’apparition des pots catalytiques et depuis l’introduction des catalyseurs.
- Les échantillons de neige fraîche : on en détecte dans 14 endroits de la vallée d’Aspe (Pyrénées) pendant deux hivers (février 2003 et mars 2004). En 2004, les teneurs en Pt, Pd et Rh sont plus élevées à cause du parc des véhicules européens ainsi que des activités minières russes.
- Les neiges et les glaces du pôle nord : les taux de platines et de platinoïdes ont augmenté entre 1990 et 2000. Cela indique une contamination de toute la stratosphère de l’hémisphère Nord par les platinoïdes, dus également au pot catalytique provenant des convertisseurs catalytiques d’automobiles.
- Les tunnels routiers, les tanneries, les pots catalytiques neufs sont des sources anthropiques de contamination par l’osmium, par l’iridium et par le platine.
Les effets chroniques du platine sur la biosphère
Le potentiel écotoxicologique et toxicologique du platine n’est pas encore bien défini, mais ses effets chroniques sur la biosphère sont prouvés. Tout d’abord, il est considéré comme un puissant catalyseur, que ce soit sous forme de très petites particules. Pouvant se multiplier rapidement, il provoque des effets synergiques potentiels. Le platine touche tous les compartiments de l’environnement et tout l’hémisphère nord par son accroissement. Depuis les dernières décennies, il dispose d’une disponibilité biologique (biodisponibilité) bien plus importante. Enfin, cet élément possède un processus d’accumulation (bioaccumulation) indéniable sur les nombreuses espèces.
Les études sur l’impact écologique et toxicologique du platine sont encore complexes. Pour cause, l’analyse des traces de platine, de palladium et de rhodium n’est pas complète. Il existe aussi des lacunes considérables sur les réels impacts environnementaux du platine. À cela s’ajoutent les émissions (industrielles ou des pots catalytiques) changeantes causées par trois facteurs. Le premier est la perte accélérée d’une partie des catalyseurs des pots catalytiques. Le deuxième est la technologie qui ne permet pas une bonne adhésion des catalyseurs. Enfin, le troisième facteur est l’utilisation de carburants inappropriés par des conducteurs.
Production du platine
En 2008, l’offre mondiale en platine était de 198 tonnes dont :
- 170 tonnes dérivent de l’extraction minière ;
- 28 tonnes proviennent du recyclage des catalyseurs automobiles.
Les entités qui produisent du platine à l’échelle internationale sont les suivantes :
- Anglo-Américain avec 70 tonnes de platine produit en 2007 ;
- Impala Platinium en Afrique du Sud avec 55 tonnes ;
- Lonmin (ex-Lonrho) avec 22 tonnes de platine ;
- Norilsk Nickel avec 20 tonnes.
La production de platine selon les pays de 2010 à 2020 :
- Afrique du Sud : 94 à 148 tonnes
- Russie : 19 à 25,5 tonnes
- Zimbabwe : 8,8 à 15 tonnes
- Canada : 3,9 à 12,5 tonnes
- États-Unis : 3,45 à 4,2 tonnes
- Autres pays : 2,3 à 6,5 tonnes
Cette production tend à s’achever en 2064 puisque le platine est une ressource non renouvelable.
Commerce du platine en France
En 2014, la France est devenue un importateur net de platine. À l’époque, le prix moyen au gramme de ce métal précieux était de 34 €. De nos jours, le platine vaut plus que l’or. Recevoir une récompense de platine symbolise d’ailleurs un trophée hautement prestigieux.