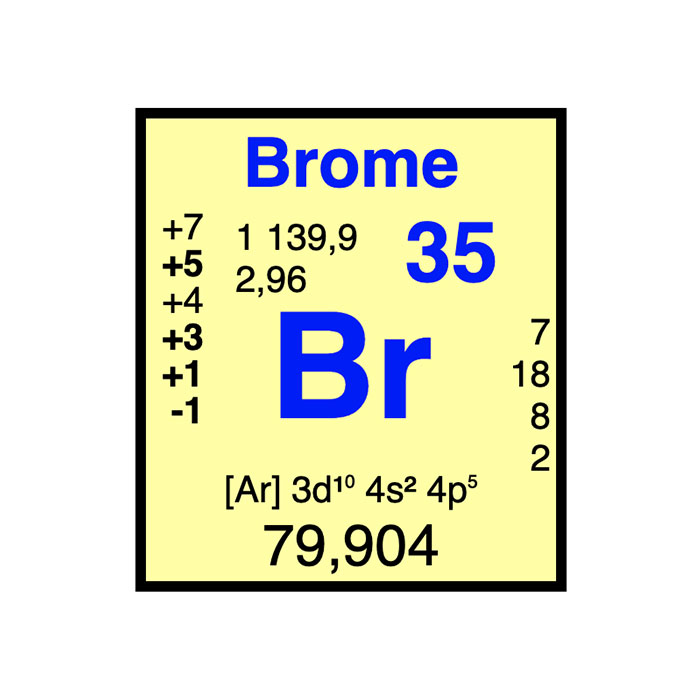
Solubilité
Concernant la solubilité dans l’eau, le dibrome est largement plus soluble que n’importe quel autre dihalogène. Elle est de 0,214 mol.L−1, soit 35 g/l. Selon la loi de Henry, plus l’« eau de brome », c’est-à-dire la solution de dibrome dans l’eau, est concentrée, plus elle produit de vapeur de dibrome. Avec un pH de l’ordre de 2,6 à une concentration élevée, elle est légèrement acide. Le dibrome peut aussi être dissout dans différents solvants organiques.
Formations de composés interhalogénés
Le brome, en tant qu’élément chimique, intervient dans la formation de composés interhalogénés comme le BrF, le BrF3, le BrCl et l’IBr. Les dihalogènes interagissent directement entre eux dans la bonne stœchiométrie. Dans le cas des composés interhalogénés comme le BrF3, le brome reste l’atome central. Sa géométrie correspond à celle indiquée par la théorie VSEPR. Il existe aussi des anions interhalogénés dits polyhalogénures comme le BrF6–.
Formation de cations et d’ions
Une autre propriété du dibrome est de former des cations dibrominium Br2+ et Br5+ dans un milieu hautement oxydant. À l’instar de l’ion triiodure I3–, il se transforme aussi en tribromure Br3– en présence d’ions bromure dans l’eau. Placé en milieu aqueux basique, il se change en ions bromure Br– et en ions bromate BrO3–. Outre le tribromure et les ions bromate, d’autres entités coexistent dans l’eau comme le Br3-, le HBrO, le BrO– et le HBrO3.
Réaction
L’addition d’une solution de bromure de sodium et d’une solution de nitrate d’argent constitue aussi une réaction classique, que ce soit en chimie analytique quantitative ou en chimie analytique qualitative. Il en résulte de la précipitation de bromure d’argent de formule AgBr. Comparé à son homologue iodure d’argent ou AgI, il est beaucoup plus soluble. En revanche, il l’est moins par rapport au chlorure d’argent ou AgCl.
Toxicologie
Sur le modèle animal
Contrairement au brome à l’état pur, l’ion bromure n’est pas considéré comme neurotoxique et perturbateur endocrinien. Cet élément jouerait même un rôle primordial dans l’architecture de la membrane basale et le développement tissulaire chez le règne animal. D’après les résultats d’une étude publiée en 2014, il serait indispensable à la biosynthèse du collagène IV. Pour autant, il n’a été rapporté à ce jour aucun symptôme ni syndrome de privation avéré.
L’ion bromure intervient dans d’autres fonctions biologiques. Sans être un facteur essentiel, cet élément a des effets bénéfiques quand il se substitue au chlore. Par exemple, l’éosinophile peroxydase permet aux éosinophiles de lutter efficacement contre les parasites multicellulaires et les bactéries responsables de diverses maladies comme la filariose et la tuberculose. Il s’agit d’une halopéroxydase formée par les éosinophiles et les ions bromure en présence de peroxyde d’hydrogène ou H2O2. Même si l’utilisation d’ions chlorure à cette fin reste possible, le bromure est toujours privilégié. Ce qui génère de l’acide hypobromeux ou hypobromite.
En revanche, la myéloperoxydase de neutrophile présente un risque pour la santé. Comme elle est susceptible d’utiliser de la désoxycytidine, du peroxyde d’hydrogène et du bromate, elle pourrait être à l’origine de mutations génétiques. De même, les a-haloesters qui sont très réactifs sont jugés comme toxiques en synthèse organique. Or, des traces qui résultent de la biosynthèse sont retrouvées dans le liquide céphalo-rachidien de certains mammifères comme les humains et les chats. Il en est ainsi du α-bromoester qui interviendrait dans la survenance du sommeil paradoxal. Toutefois, son véritable rôle reste encore à clarifier.
Chez l’être humain
Étant toxique et corrosif, le brome élémentaire cause chez l’homme des brûlures chimiques, tant sur la peau et les muqueuses que sur la chair. Il est aussi déconseillé de l’inhaler sous forme de vapeur ou de gaz. Au-delà d’un certain seuil, l’inhalation peut provoquer la suffocation et conduire à la mort. En dessous, elle irrite les voies respiratoires. Les irritations se manifestent par la toux. Par ailleurs, il faut faire attention à une exposition répétée ou prolongée. Cela augmente les risques d’infections bronchiques et de détérioration de l’état de santé en général.
Plus précisément, la limite d’exposition admissible ou PEL à une moyenne pondérée dans le temps ou TWA est fixée à 0,1 ppm. Cette valeur a été définie par l’Occupational Safety and Health Administration ou OSHA aux États-Unis. Elle a été renforcée par l’Institut national pour la sécurité et la santé au travail ou NIOSH avec une limite d’exposition recommandée ou REL de 0,1 ppm et une limitation de 0,3 ppm à court terme. Au-delà de 3 ppm, l’exposition au brome est considérée comme immédiatement dangereuse pour la vie et la santé.
Comparé au brome élémentaire, le bromure est peu toxique. Pour autant, son apport journalier ne doit pas excéder les 8 mg, selon Nielsen. Une exposition chronique au bromure à un taux élevé est susceptible de dégrader la membrane des neurones. À terme, elle induit une intoxication chronique appelée bromisme qui résulte de l’entrave progressive de la transmission de l’influx nerveux.
Comme la demi-vie d’élimination du bromure est estimée entre 9 et 12 jours, une exposition prolongée présente un risque d’accumulation excessive. Ainsi, 0,5 à 1 g par jour de bromure pendant une longue période peut causer le bromisme. Cela s’explique principalement par la neurotoxicité du brome qui provoque de la somnolence et des convulsions, mais aussi de la psychose et du délire. Cependant, les décès suite à une intoxication aiguë restent rares à ce jour. Seules des perturbations importantes, voire graves, de diverses fonctions ont été rapportées comme la fonction neurologique et la fonction dermatologique.
Facteur d’autisme
Selon une étude réalisée par Mireia Gascon en 2011, certains produits bromés persistants sont associés à l’apparition de difficultés neurodéveloppementales. Elles sont consécutives à une exposition prénatale ou postnatale. Ainsi, elles concernent aussi bien le fœtus que l’enfant âgé de 0 à 48 mois. Les produits incriminés sont utilisés en tant que retardateurs de flamme de type polybromodiphényléthers ou PBDEs. Il regroupe 209 composés chimiques dont l’utilisation comme agent ignifugeant a été très répandue entre 1990 et 2010. Dans les années 1970 et 1980, ils ont aussi été utilisés à des quantités massives pour les forages de pétrole.
En 2013, une autre équipe de chercheurs a mis en évidence le risque de troubles du spectre autistique chez les enfants dont la mère a souffert d’hypothyroïdie pendant le premier trimestre de grossesse. Or, en tant que perturbateur endocrinien, le brome est l’une des causes probables d’hypothyroïdie. Comme cet élément chimique est un halogène proche de l’iode, il peut le remplacer au niveau du système thyroïdien.
D’autres études publiées en 2014 et 2015 ont établi le caractère nocif des diphényléthers polybromés. Ils impactent le neurodéveloppement des enfants de 9 à 12 ans et l’âge de survenue de la puberté chez les adolescents. Puis, en 2016, il a été admis que certains troubles du spectre autistique et retards mentaux sont consécutifs à des dysfonctionnements endocriniens. Ils sont survenus au cours de la grossesse ou à la naissance et touchent principalement l’axe thyroïdien. La sévérité des symptômes serait proportionnelle à la déficience en iode.
Cette corrélation confirme les liens découverts en 2012 et en 2013 par le biais de deux études réalisées sur des souris. La première a été menée sur des souris génétiquement modifiées. La mutation du gène MECP2 du chromosome X a conduit au développement d’un trouble comparable au syndrome de Rett. Quand elles ont été exposées à un PBDE, plus précisément le BDE-47, elles ont donné naissance à des souriceaux souffrant de déficits de sociabilité et d’apprentissage. La deuxième a mis en exergue la neurotoxicité des PBDEs, même à faibles doses. Les chercheurs ont induit des lésions cérébrales chez des souris. Ils ont utilisé du BDP-49, un autre PBDE, pour inhiber le processus de production d’ATP mitochondriale. Ce qui a privé d’énergie les cellules du cerveau.
Facteur (in utero ou dans l’enfance) de troubles du développement
Une exposition aux PBDEs, que ce soit in utero ou dans l’enfance, a des effets neurotoxiques avérés. Ils se manifestent par des troubles du développement, en particulier chez les petits garçons. En effet, les petites filles ne semblent pas être affectées. Une étude réalisée sur 208 enfants âgés de 8 ans a notamment mis en évidence une dégradation de la fonction exécutive. Ce qui se traduit par des troubles du comportement, mais aussi de l’attention.
L’étude a porté sur une évaluation des effets d’une exposition simultanée à certains PBDEs. Il en est ressorti que des concentrations prénatales élevées engendrent une baisse des taux de TSH à 3 ans. Ce phénomène a déjà été constaté auparavant chez des animaux de laboratoire. Pour rappel, en tant que principal régulateur de la thyroïde la TSH ou Thyroid Stimulating Hormone, elle assure l’équilibre des hormones thyroïdiennes dans le sang.
Les traces d’une exposition à des PBDEs au cours de la grossesse ont été retrouvées dans le cordon ombilical du nouveau-né. La mesure des ignifugeants a été réalisée juste après la naissance. Or, ces substances ont la capacité de passer au travers de la barrière placentaire qui protège le fœtus. Ce qui n’est pas sans conséquence sur le développement moteur de l’enfant, même quelques années plus tard.
Une autre étude menée en 2019 confirme ce risque plus important chez les petits garçons. Les enfants ayant des traces de PBDEs dans leur cordon ombilical ont été suivis à différents stades de leur croissance : 2, 3, 5, 7 et 9 ans. Il a été observé que les effets nocifs persistent même jusqu’à l’adolescence. Ils affectent aussi bien la mémoire verbale et visuelle que la mémoire de travail. Les résultats des tests ont montré des pertes de 5 à 8 points.
Dans le monde animal
Les composés organobromés proviennent essentiellement des organismes marins. La plupart du temps, ils se forment sous l’action d’une enzyme appelée vanadium bromoperoxidase qui est secrétée par des algues. Il existe plus de 1 600 composés organobromés, dont le plus répandu est le bromure de méthyle de formule CH3Br. Les algues marines en produisent plus de 55 000 tonnes par an.