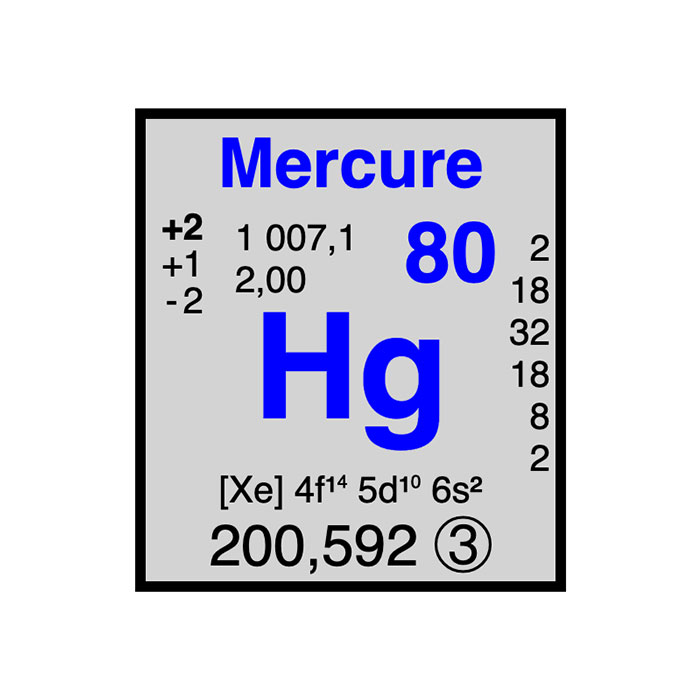
Caractéristiques du mercure
- Symbole : Hg
- Masse atomique : 200,59 ± 0,02 u
- Numéro CAS : 7439-97-6
- Configuration électronique : [Xe]4f145d10 6s2
- Numéro atomique : 80
- Groupe : 12
- Bloc : Bloc d
- Famille d’éléments : Métal pauvre ou métal de transition
- Électronégativité : 2,00
- Point de fusion : −38,842 °C




