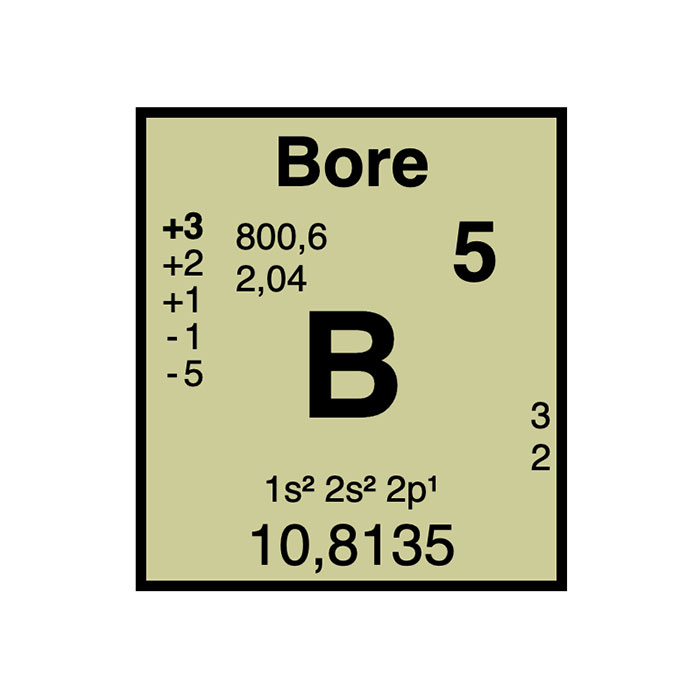
Caractéristiques du Bore
- Symbole : B
- Masse atomique : 10,81 u1
- Numéro CAS : 7440-42-86
- Configuration électronique : [He]2s2 2p1
- Numéro atomique : 5
- Groupe : 13
- Bloc : Bloc P
- Famille d’éléments : Métalloïde
- Électronégativité : 2,04
- Point de fusion : 2 075 °C4


