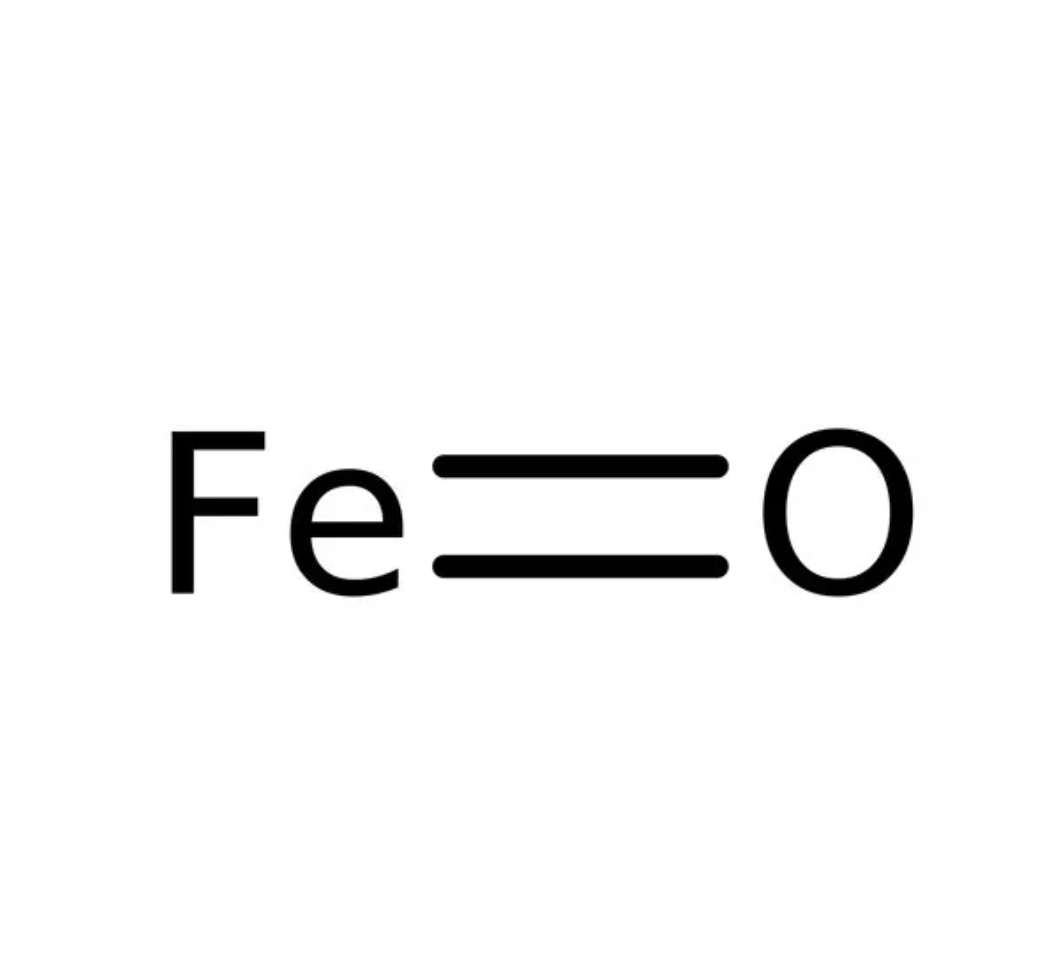L’E172, plus exactement les E172, puisqu’ils sont au nombre de trois, sont des mélanges chimiques comportant du fer et de l’oxygène. Ce colorant est couramment utilisé dans l’industrie alimentaire, mais également dans d’autres secteurs comme les produits pharmaceutiques ou les cosmétiques. Il est naturellement présent dans les sols et dans les roches, mais produit synthétiquement dans les milieux industriels.
La description des oxydes de fer
Les oxydes de fer naturels, résultant d’un mélange d’argile et de sable, sont appelés « terres » ou « ocres ».
La terre de Sienne est jaunâtre ou rouge-orangée. La terre d’Ombre est brune ou brun rougeâtre, se distinguant de la première par la présence de manganèse.
Les ocres possèdent une plus faible proportion en oxyde de fer que les terres. L’ocre jaune varie du jaune verdâtre au jaune orangé, tandis que l’ocre rouge présente différentes nuances brun-rouge.
Les oxydes de fer naturels sont la maghémite, l’hématite, les oxyhydroxydes de fer, le lépidocrocite, la limonite et la goethite. Ils donnent une couleur rouge au sol. En revanche, les ocres, qui sont à base de kaolinite-goethite, colorent les sols en rouille, jaune et brun rougeâtre à brun foncé.
Ces substances sont d’origine naturelle. En revanche, la production synthétique d’oxydes de fer se pratique couramment aujourd’hui. L’oxydation des métaux s’obtient en plongeant des feuillets métalliques dans des bacs acides avec électrolyse. Les couleurs obtenues varient en fonction du métal et du temps passé dans les bacs.
Dans l’agroalimentaire, les teintes disponibles qui sont autorisées dans les aliments enrichis ou transformés sont les suivantes :
- le noir dont le code est E172(i) ;
- le rouge qui est codé E172(ii) ;
- le jaune au code E172(iii).
Le brun est la couleur la plus utilisée dans les mélanges commerciaux.
L’historique des oxydes de fer
Les substances minérales ont été utilisées depuis au moins 2,6 millions d’années, notamment pour fabriquer des outils de pierre. Plus tard, certaines d’entre elles ont servi comme pigments.
Les oxydes de fer, notamment les nuances rouges, ont permis aux hommes des cavernes de laisser des traces de leur présence. Ils ont, par exemple, dessiné des animaux pour assurer une chasse abondante.
Des dessins rupestres ont été constatés à Altamira, en Espagne, à Lascaux, en France et à Saubia, en Allemagne. Ils ont été peints entre 40 000 et 10 000 ans avant notre ère. Les couleurs ont été créées à partir d’argiles riches en oxyde de fer.
La métallurgie du fer n’a commencé que vers 2500 avant J.-C. Son développement à partir des oxydes de fer a boosté l’utilisation des bas fourneaux qui peuvent atteindre des températures très élevées. Celles-ci sont obtenues par combustion du charbon de bois et permettent facilement la réduction de l’oxyde de fer.
Les oxydes de fer extraits naturellement sont encore abondamment utilisés aujourd’hui. Cependant, les types synthétiques produits à partir de sulfate ferreux le sont beaucoup plus avec de meilleures performances pigmentaires. Ils présentent une teinte naturelle, mais aussi des propriétés techniques, physiques et chimiques exceptionnelles.
La structure de l’E172
E172 est le numéro de code attribué à trois colorants alimentaires. Leur classification est définie en fonction de leur état respectif d’oxydation. Ainsi, il existe :
- le type ii, connu sous le nom d’ « oxyde ferreux », de formule chimique FeO ;
- le type ii, iii, dénommé « oxyde magnétique », « tétroxyde de trifer » ou « magnétite », dont la formule est Fe3O4 ou FeO.Fe2O3.
- le type iii, appelé « oxyde ferrique » ou « sesquioxyde de fer », de formule chimique Fe2O3.
Ce dernier type se présente sous cinq phases :
- α-Fe2O3 appelée « hématite », grise sous forme de cristaux, mais rouge en poudre, couleur de la rouille ;
- β-Fe2O3 ;
- γ-Fe2O3 ;
- ε-Fe2O3 ;
- Fe2O3 amorphe
Ils se déclinent sous deux types de structure : cubique et rhomboédrique.