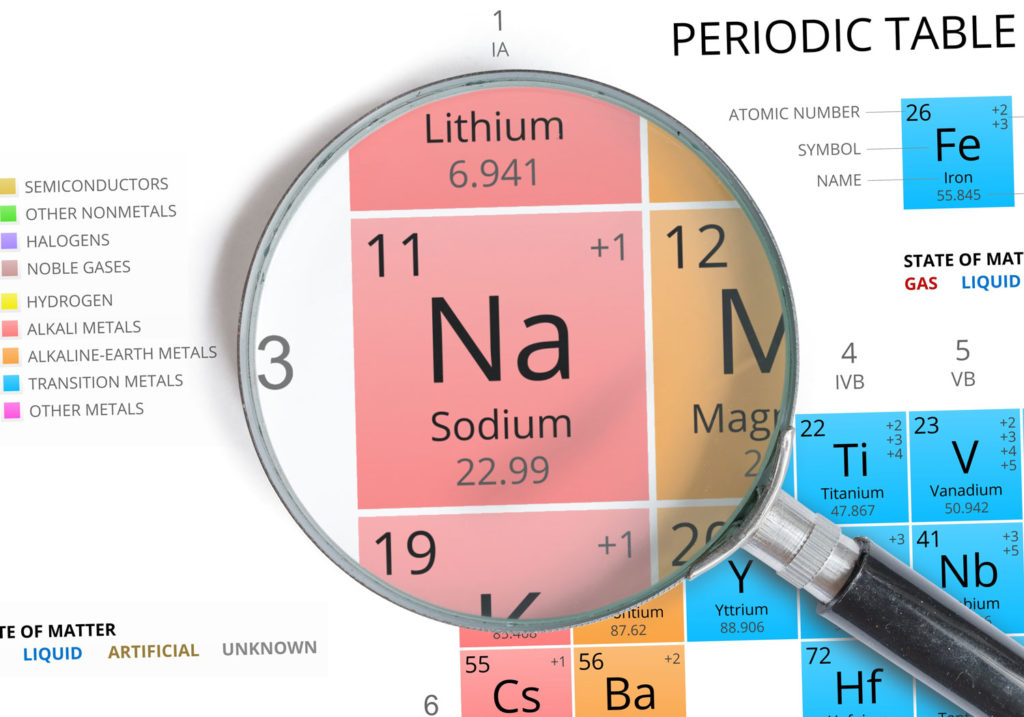
Caractéristiques du sodium
- Symbole : Na
- Masse atomique : 22,989 769 28 ± 2 ×10−8u1
- Numéro CAS : 7440-23-5
- Configuration électronique : [Ne]3s1
- Numéro atomique : 11
- Groupe : 1
- Bloc : Bloc S
- Famille d’éléments : Métal alcalin
- Électronégativité : 0,93
- Point de fusion : 97,80 °C