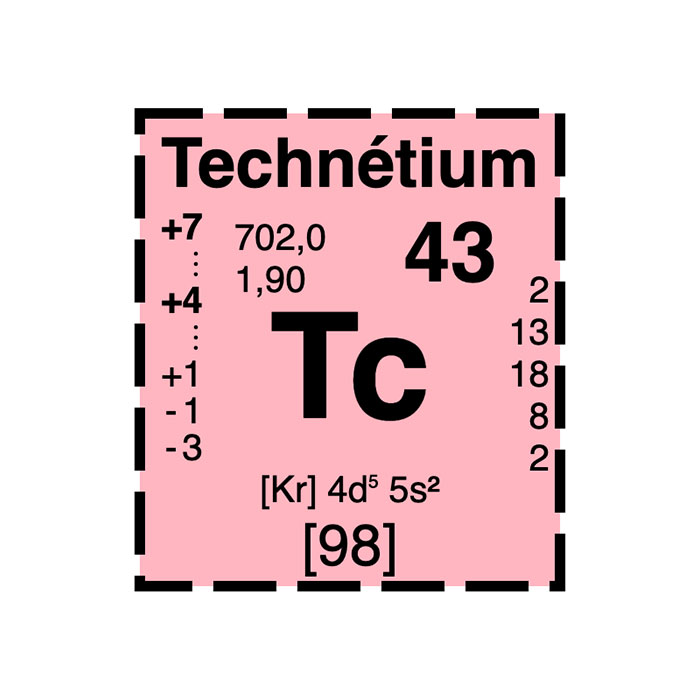
Caractéristiques du technétium
- Symbole : Tc
- Masse atomique : 98u
- Numéro CAS : 7440-26-8
- Configuration électronique : [Kr] 4d5 5s2
- Numéro atomique : 43
- Groupe : 7
- Bloc : d
- Famille d’éléments : Métal de transition
- Électronégativité : 2,16
- Point de fusion : 2 157 °C



