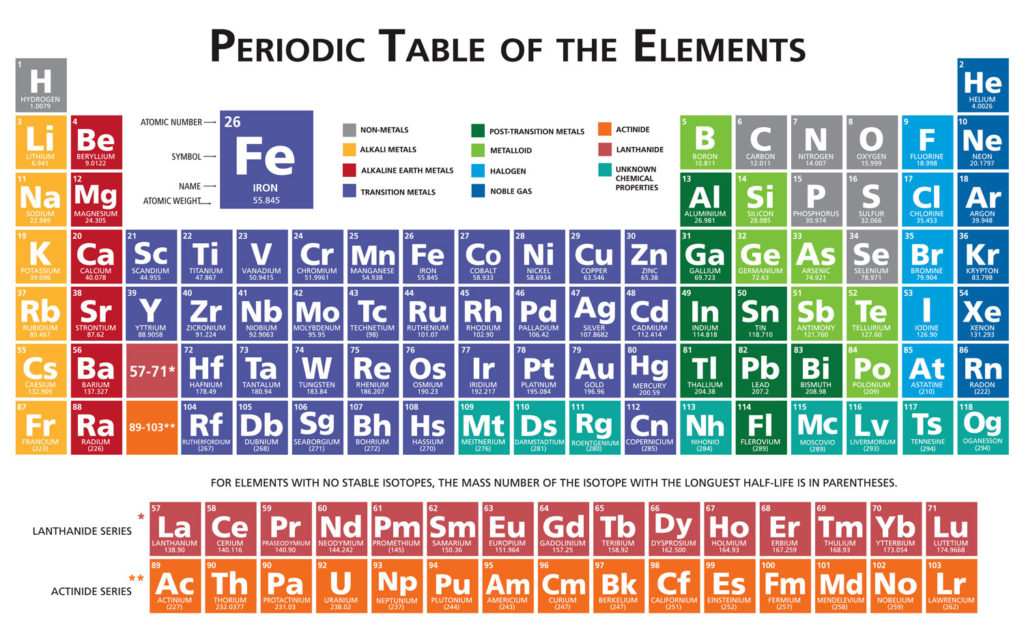
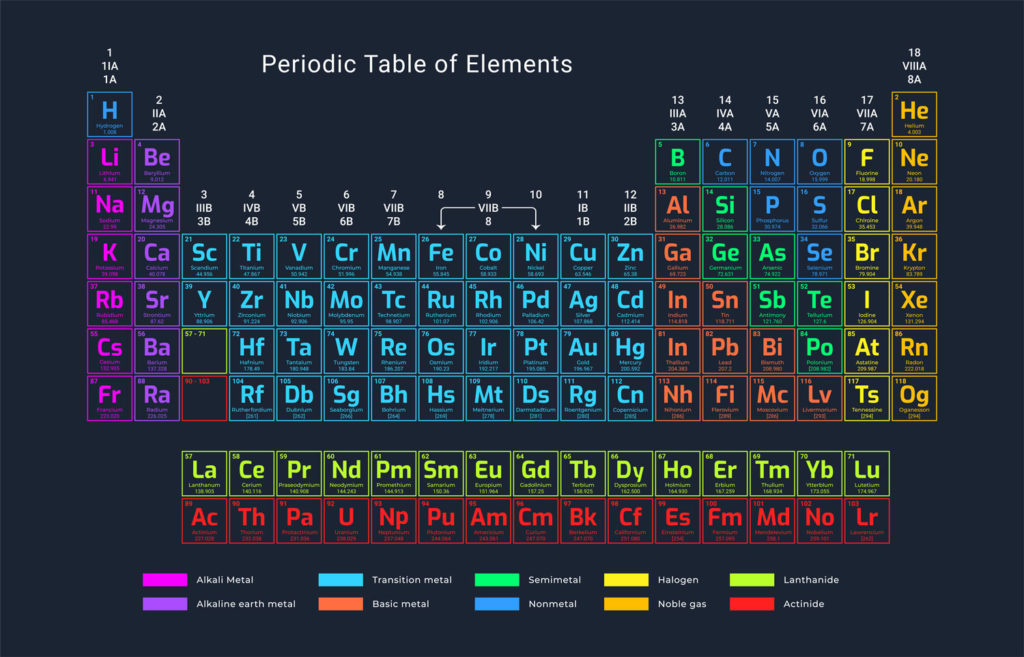
Caractéristiques des numéros atomiques
- Chaque élément chimique a un numéro atomique, symbolisé par la lettre Z.
- Le numéro atomique correspond au nombre total de protons dans l’élément.
- L’atome est constitué de protons, de neutrons et d’électrons.
- Les protons et les neutrons se trouvent dans le noyau de l’atome, appelé nucléons.
- En résumé, le numéro atomique est le nombre de protons dans un élément chimique, et l’atome est formé de nucléons et d’électrons.