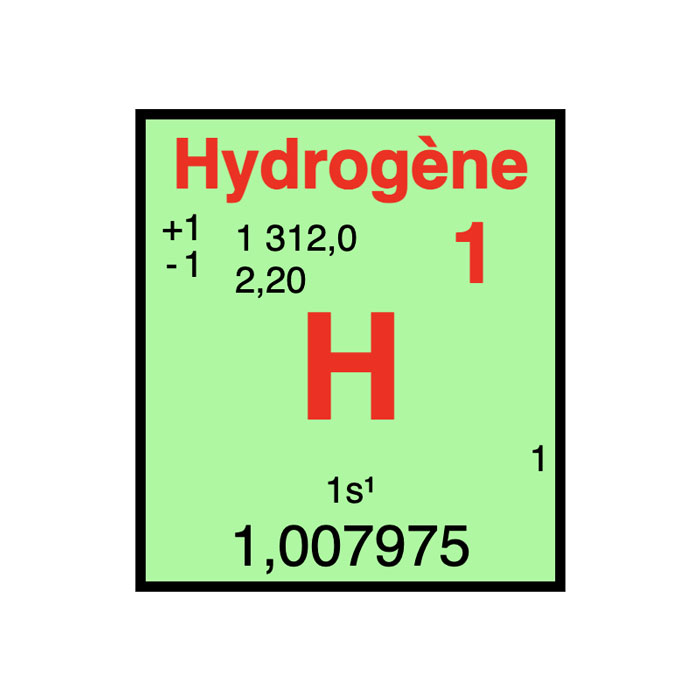
Caractéristiques de l’hydrogène
- Symbole : H
- Masse atomique : 1,00784 u
- Numéro CAS : 1333-74-0
- Configuration électronique : 1s1
- Numéro atomique : 1
- Groupe : 1
- Bloc : Bloc S
- Famille d’éléments : Non-métal
- Électronégativité : 2,2
- Point de fusion : -259,2 °C



