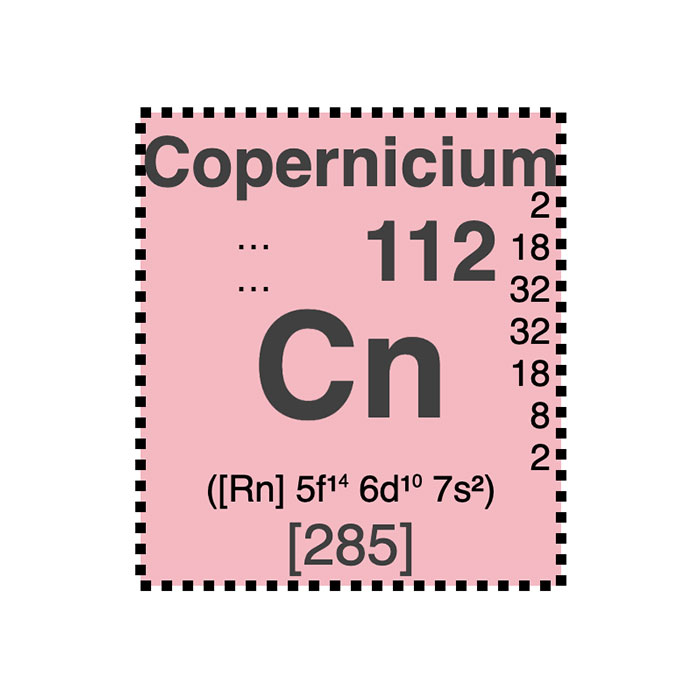
Caractéristiques du copernicium
- Symbole : Cn
- Masse atomique : 285 u
- Numéro CAS : 54084-26-3
- Configuration électronique : [Rn] 5f14 6d10 7s2
- Numéro atomique : 112
- Groupe : 12
- Bloc : Bloc d
- Famille d’éléments :Métal de transition
ou métal pauvre - Électronégativité : –
- Point de fusion : –

