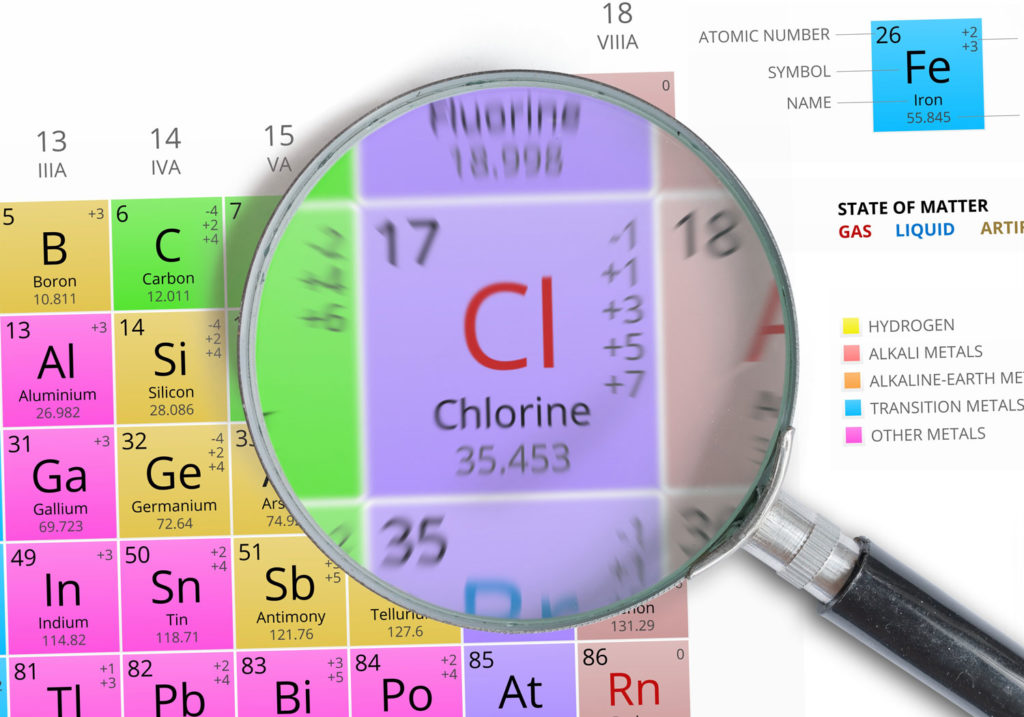
Caractéristiques du chlore
- Symbole: Cl
- Masse atomique: 35,453 ± 0,002u1
- Numéro CAS: 7782-50-55
- Configuration électronique: [Ne] 3s2 3p5
- Numéro atomique: 17
- Groupe: 17
- Bloc: Bloc P
- Famille d’éléments: Halogène
- Électronégativité: 3,04
- Point de fusion: −101,5 °C1