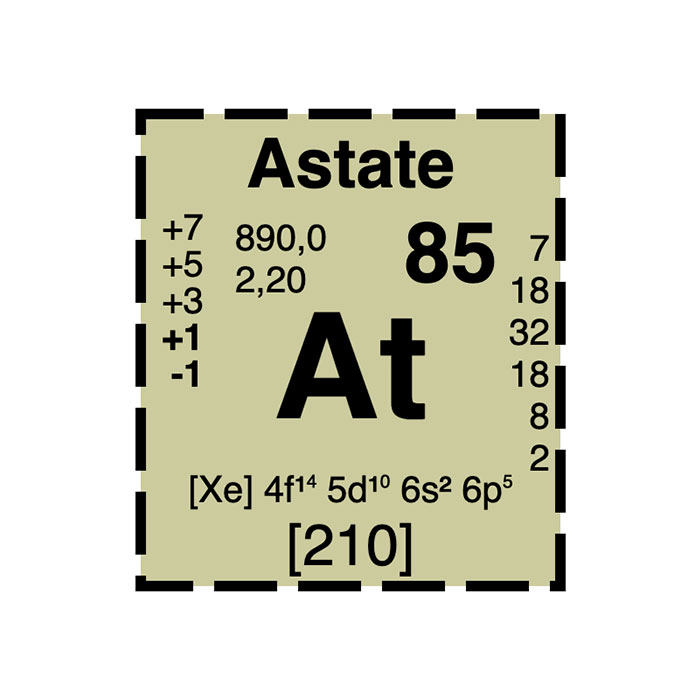
Caractéristiques de l’astate
- Symbole : At
- Masse atomique : 210 u
- Numéro CAS : 142364-73-6
- Configuration électronique : [Xe] 4f14 5d10 6s2 6p5
- Numéro atomique : 85
- Groupe : 17
- Bloc : Bloc p
- Famille d’éléments :Halogène/métalloïde
- Électronégativité : 2,2
- Point de fusion : 302 °C