L’acétate de sodium, aussi connu sous le code E262, est l’un des plus anciens conservateurs alimentaires. Il est obtenu par l’association de sel de sodium et d’acide acétique dont la désignation est E260. Il peut avoir une origine naturelle ou synthétique et a un grand nombre d’utilisations.
La description de l’acétate de sodium
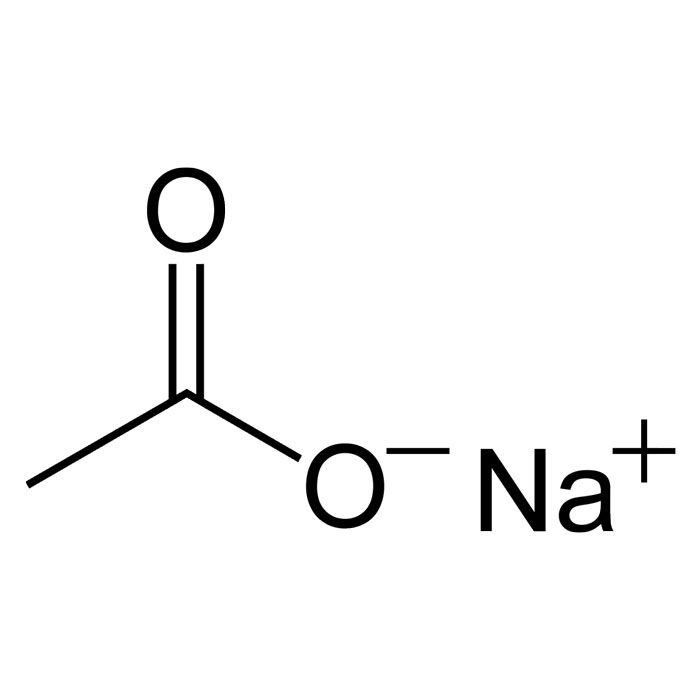
Aussi appelé « éthanoate de sodium », l’acétate de sodium est abrégé NaOAc. Il se présente sous une apparence de solide cristallin blanc en général inodore, mais parfois avec une légère odeur de vinaigre. Son aspect de cristaux blancs est similaire à la texture du sel. Il est aussi disponible sous la forme d’une poudre hygroscopique qui est facilement soluble dans l’eau. En se dissociant, il forme des ions sodium (Na+) et des ions acétates.
De manière artisanale, pour en obtenir, il suffit de mélanger du bicarbonate de soude avec du vinaigre qui est appelé acide acétique en chimie. Ce mélange est la forme anhydre de l’acétate de soude, sans eau associée. En revanche, la forme trihydratée contient trois molécules d’eau pour une molécule d’acétate de sodium. Elle est obtenue en atelier par la réaction d’hydroxyde de carbone avec de l’acide acétique dans de l’eau froide.
Le sel sodique de l’acide acétique est un composé polyvalent possédant de nombreuses propriétés qui lui permettent d’être utilisé dans divers domaines. Toutefois, les différentes formes (anhydre ou trihydrate) peuvent avoir un impact sur les applications.
La structure de l’acétate de sodium
L’acétate de sodium a pour formule brute CH3COONa. Sa structure est composée d’ions sodium (Na⁺) et d’ions acétate (CH₃COO⁻). Chaque ion acétate comporte un atome de carbone (C) relié à trois atomes d’hydrogène (H3) et à groupe carboxyle (COO⁻).
L’éthanoate de sodium sert de base conjuguée à l’acide acétique. De ce fait, il peut être synthétisé en mélangeant ce dernier avec de la soude caustique, du carbonate de sodium ou du bicarbonate de soude. Voici les réactions concernées :
Avec la soude caustique : CH3COOH + NaOH → CH3COONa + H2O
Avec le carbonate de sodium : 2 CH3COOH + Na2CO3 → 2 CH3COONa + H2CO3
H2CO3 → CO2 + H2O
Avec le bicarbonate de sodium : CH3COOH + NaHCO3 → CH3COONa + H2CO3
H2CO3 → CO2 + H2O
Suivant la réaction de substitution, il peut être utilisé pour procéder à la synthèse d’esters : CH3COONa + RBr → CH3COOR + NaBr Par le biais de décarboxylation par pyrolyse avec hydroxyde de sodium, il peut aussi former du méthane : CH3COONa + NaOH → CH4 + Na2CO3