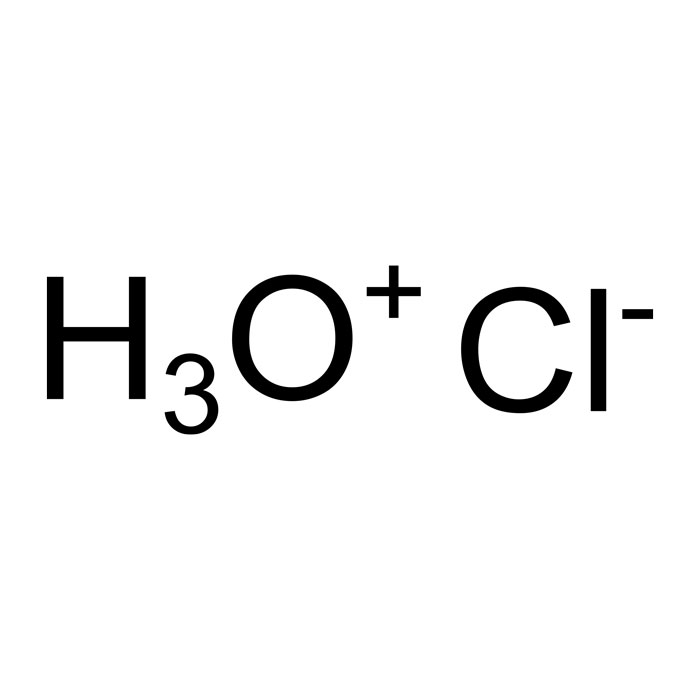Procédé au sulfate
Cette méthode fait intervenir de l’acide sulfurique, ainsi que des sels contenant du chlorure, comme le chlorure de sodium (NaCl).
Le procédé se fait en deux étapes.
La première est réalisée sous une température comprise entre 150 et 300 °C.
La seconde a lieu dans un environnement de 550 à 600 °C, et en présence d’une quantité de sel supplémentaire.
Le produit obtenu suite à ces deux réactions est du sulfate de sodium et du chlorure d’hydrogène gazeux. Ce dernier est ensuite dissout dans l’eau, ce qui permet d’avoir de l’acide chlorhydrique.
Chloration
En chimie, la chloration fait référence à une réaction de substitution. En utilisant cette technique pour produire du chlorure de vinyle à partir de 1,2-dichloroéthane, il est possible d’obtenir du chlorure d’hydrogène.
En pratique, un atome de chlore du Cl2 remplace un atome d’hydrogène. Ce dernier, une fois libéré, s’associe au second atome de chlore, conduisant ainsi à la formation du chlorure d’hydrogène.
Après la chloration, la synthèse d’acide chlorhydrique peut se faire selon trois procédés.
Le premier consiste en la distillation fractionnée des produits résultant de cette réaction après le passage à l’état liquide.
Le deuxième est l’absorption du chlorure d’hydrogène dans l’eau.
Le troisième réside dans la condensation des composés chlorés.
Fluoration
Dans une réaction de fluoration, l’atome de fluor prend la place du chlore, qui se fixe ensuite sur l’atome d’hydrogène pour former une molécule de chlorure d’hydrogène.
L’acide chlorhydrique s’obtient par la dissolution du HCl dans l’eau.
Processus Hargreaves
Cette méthode implique une réaction chimique entre le chlorure de sodium, le dioxyde de soufre, l’eau et l’air. Elle génère du sulfate de sodium, ainsi que du chlorure d’hydrogène.
2 NaCl + SO2 + ½ O2 + H2O → Na2SO4 + 2 HCl
À noter que tout le processus est réalisé sous une température de 450 °C.
Combustion des déchets toxiques
Les déchets toxiques utilisés pour la synthèse sont les composés organiques chlorés. Ceux-ci seront incinérés à une température de plus de 1 000 °C, et dans des unités résistant à la chaleur.
Pour récupérer l’acide chlorhydrique, le gaz produit par la combustion est refroidi à l’eau. Cette vapeur contient, en effet, du dioxyde de carbone, du chlorure d’hydrogène et de l’eau.
L’E507 en nutrition
Dans l’industrie agroalimentaire, l’E507 est considéré comme étant un régulateur d’acidité et un acidifiant. Il permet ainsi d’ajuster et/ou de maintenir le pH d’un aliment afin que le produit ait la saveur souhaitée.
Les types de denrées où cet additif est présent sont les suivants :
- fromages ;
- bières et boissons non alcoolisées ;
- assortiment d’épices ;
- sirops ;
- aliments pour bébé ;
- mayonnaise et diverses sauces ;
- jus de légumes ;
- conserves ;
- produits à base de maïs.
L’acide chlorhydrique intervient également dans la production de colorants alimentaires, d’édulcorants, de gélatine, d’acide citrique et de protéines végétales hydrolysées.
Il est bon de préciser que cet additif peut être consommé par les personnes suivant un régime alimentaire spécifique. Il convient, notamment, aux individus qui ne mangent pas de produit à base de lait, d’œuf et de tout organe prélevé sur une espèce animale (végétalien). Il est également casher et halal.
En revanche, il est prohibé dans les aliments portant le label « BIO ».
Autres utilisations de l’E507
L’E507, outre son application dans la nutrition, est également utilisé dans d’autres domaines.
Il est ainsi employé dans l’industrie pharmaceutique lors de la synthèse de certains médicaments, notamment ceux qui servent à corriger les carences en acide. En médecine, il occupe également le rôle de catalyseur et d’agent réducteur.
En usage domestique, l’acide chlorhydrique se retrouve dans les produits d’hygiène.
Enfin, dans le secteur industriel, il intervient dans le décapage des aciers et de l’aluminium. Il permet également de nettoyer les métaux, et de relancer le flux des gaz ou des pétroles dans les puits.
Toxicité et précautions d’usage
L’E507, quand il est utilisé à très faible dose dans les denrées alimentaires, ne présente aucun risque pour la santé.
Cependant, pour les autres usages, il est nécessaire de faire preuve de prudence lors de la manipulation de l’acide chlorhydrique. En effet, cette substance est extrêmement corrosive. Elle peut également provoquer de la gêne respiratoire, ainsi que des irritations oculaires et cutanées.
Afin d’éviter ces symptômes, il existe des précautions à prendre avant de manier la solution. À titre d’exemple, il est possible de citer le port systématique de gants, d’un masque et de lunettes de protection. Il est également conseillé d’éviter d’ajouter de l’eau dans une solution de HCl pour prévenir les projections d’acide.