Le dioxyde de soufre est un composé chimique incolore aux multiples usages. Utilisé depuis longtemps comme agent de fumigation et comme élément désinfectant et blanchissant, il trouve aujourd’hui de nombreuses applications tant industrielles qu’alimentaires grâce à ses diverses caractéristiques. En étant libéré dans l’atmosphère par la combustion d’énergies fossiles, il figure parmi les éléments ayant déclenché les pluies acides.
La description du dioxyde de soufre
Le dioxyde de soufre est un gaz incolore aux propriétés irritantes et réductrices. Il possède une odeur caractéristique et piquante, discernable dès une concentration de 0,45 ppm, bien que celle-ci ne constitue pas un indicateur fiable d’une exposition dangereuse. Néanmoins, en raison de cette émanation suffocante, il peut causer une gêne respiratoire ou provoquer une sensation d’étouffement. En outre, il est susceptible d’irriter les yeux et les membranes muqueuses. Ces effets peuvent se faire ressentir dans l’immédiat ou après un certain délai.
Ce composé chimique se transforme en liquide lorsqu’il est soumis à une pression suffisamment élevée. Par ailleurs, son point d’ébullition est de -10 °C, indiquant la température à laquelle il passe à l’état gazeux. Étant donné qu’il est plus lourd que l’air, il a tendance à s’accumuler près du sol.
L’oxyde sulfureux est le principal polluant atmosphérique issu de l’utilisation de combustibles fossiles contenant du soufre tels que :
- le charbon ;
- le gazole ;
- le fioul lourd.
Le dioxyde de soufre est rejeté par des sources fixes, dont les centrales électriques, les chaufferies urbaines et les procédés de fusion du cuivre. Il est aussi produit par de multiples facteurs mobiles, comme le chauffage domestique ou les véhicules diesel. Présent naturellement près des volcans, ce gaz a contribué à l’émergence des pluies acides à cause de ses émissions anthropiques. Ayant la capacité de se dissoudre facilement dans l’eau, il trouve des applications dans les brasseries, les batteries, l’industrie textile et l’agroalimentaire.
L’historique du dioxyde de soufre
Le dioxyde de soufre est utilisé depuis des siècles comme désinfectant, particulièrement dans le domaine vinicole. En effet, les viticulteurs brûlaient du soufre à l’intérieur des cuves. Au XXe siècle, avec le développement du génie chimique, ce gaz incolore a trouvé de nouvelles applications.
À partir des années 1950, les émissions d’oxyde sulfureux liées à la combustion d’énergies fossiles ont provoqué une importante pollution atmosphérique, à l’origine du phénomène des pluies acides. Ce phénomène a ainsi rendu nécessaire la mise en place de réglementations spécifiques visant à limiter la teneur en soufre des carburants. Elles s’accompagnent de dispositions relatives à la baisse de l’utilisation du charbon au profit des énergies moins émettrices comme le gaz ou le nucléaire. Les teneurs atmosphériques en oxyde sulfureux ont diminué de façon significative au cours des décennies suivantes.
Les propriétés du dioxyde de soufre
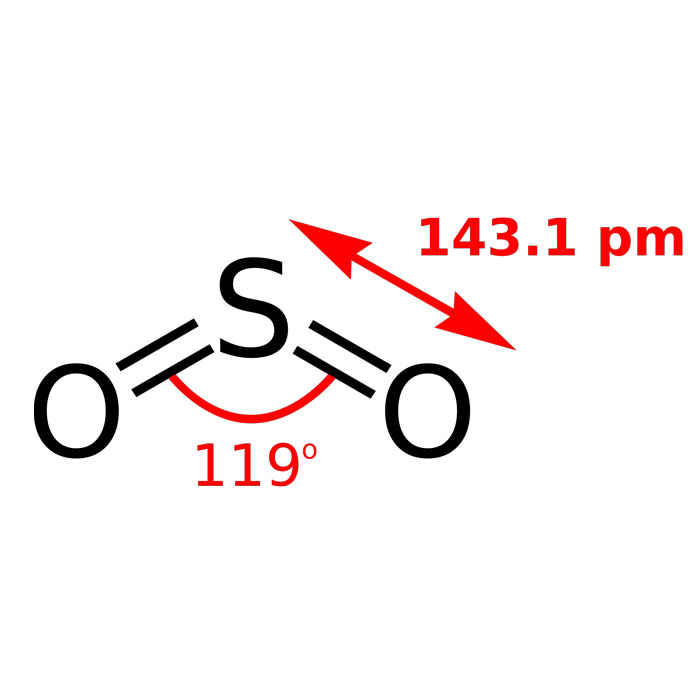
La structure du dioxyde de soufre comprend un atome de l’élément chimique de numéro atomique 16, lié par une double liaison covalente à deux atomes d’oxygène. Cette configuration particulière, dans laquelle l’atome central de soufre est entouré de deux atomes identiques, lui confère une stabilisation mésomère.
À température et pression normales, l’oxyde sulfureux se présente à l’état gazeux. Cependant, lorsqu’il est comprimé à une pression de 3,3 bars, il se transforme en liquide. Sa solubilité élevée dans l’eau permet de former des solutions aqueuses légèrement acides. Par ailleurs, ce composé chimique possède de nombreuses vertus qui expliquent son utilisation de longue date dans différents domaines.