Le sulfate d’héparane ou héparane sulfate (HS) est un polymère complexe de la famille des glycosaminoglycanes. Ces polysaccharides sont présents en abondance à la surface cellulaire et dans les matrices interstitielles. Ils sont impliqués dans divers processus physiologiques et pathologiques par leur positionnement stratégique entre la cellule et son micro-environnement. Cette implication est aussi due à leur capacité à fixer et moduler l’activité d’un grand nombre de protéines.
Description du sulfate d’héparane
Le sulfate d’héparane constitue une molécule polysaccharide présente dans le milieu extracellulaire des tissus animaux. Il se lie aux protéoglycanes et se trouve à la surface des cellules. Les glycosaminoglycanes forment une sous-famille comprenant l’acide hyaluronique, les héparanes sulfate et l’héparine. Ces composés partagent une structure commune, avec l’hexosamine étant une glucosamine.
Historique du sulfate d’héparane
Le sulfate d’héparane a été initialement désigné sous le nom d’« héparine monosulfate ». Il fait référence au composé en tant que sous-produit obtenu lors de la purification de l’héparine. Le concept de protéoglycane émerge dans les années 50. Il met en évidence l’association constante des glycosaminoglycanes avec une composante protéique dont la nature covalente a été confirmée par Muir et al. en 1958. En 1966, Roden et Smith ont réussi à caractériser le motif tétrasaccharidique impliqué dans l’attachement des chaînes polysaccharidiques à un noyau protéique.
Les années 70 voient les premières données sur la fine configuration des héparanes sulfate et de l’héparine. Un moment clé de ces travaux est l’identification du motif pentasaccharidique spécifique de fixation et d’activation de l’antithrombine III. Au cours des deux dernières décennies, la recherche sur les glycosaminoglycanes s’est multipliée, révélant de nouveaux ligands et fonctions biologiques
Structure et propriétés du sulfate d’héparane
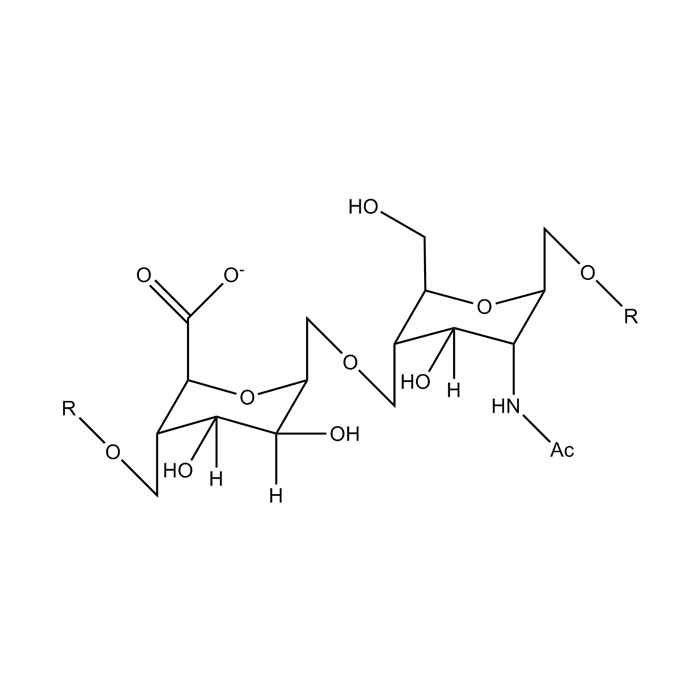
Sa structure de base comprend un acide D-Glucuronique ou un acide L-Iduronique lié par des liaisons α-1→4 à un N-acétyl-glucosamine (glucose avec en carbone 2 : NHSO3-). La nature de la connexion entre les disaccharides varie selon la présence d’acide L-Iduronique (α-1→4) ou d’acide D-Glucuronique (β-1→4).
L’héparine et les héparanes sulfate partagent une organisation structurale commune. Ces deux composés sont constitués par la répétition d’une unité disaccharidique. Elle contient une glucosamine associée soit à un acide glucuronique, soit à un acide iduronique. Ils se distinguent par un degré de sulfatation élevé. Le résidu glucosamine peut être N-acétylé, N-sulfaté, ou parfois présenter un groupement amine non substitué. Des O-sulfatations peuvent également se produire en C-2 de l’acide uronique, en C-6 de la glucosamine, et en C-3. Ces changements combinés génèrent 48 motifs disaccharidiques différents, assurant une diversité considérable le long de la chaîne saccharidique.
La structure des héparanes sulfate est exprimée par une séquence de disaccharides de type acide glucuronique N-acétyl glucosamine. Les modifications de ce motif de base comportent la N-déacétylation/N-sulfatation des glucosamines et l’épimérisation de l’acide glucuronique en acide iduronique. Elles incluent également la O-sulfatation de groupements hydroxyles spécifiques.
Ces disaccharides forment des zones relativement homogènes et faiblement modifiées ainsi que des domaines sulfatés, caractérisés par des séquences hypervariables.
La biosynthèse du sulfate d’héparane est un processus complexe et hautement régulé qui se déroule dans l’appareil de Golgi. Elle comprend :
- la formation d’un motif tétrasaccharidique linker pour l’attachement de la chaîne polysaccharidique au core protéique ;
- la synthèse d’une chaîne saccharidique immature (pro-héparane) ;
- la maturation du polysaccharide par une série de réactions de modification, telles que la N-déacétylation/N-sulfatation, l’épimérisation et la sulfatation.
La phase d’élongation de la chaîne saccharidique à partir du tétrasaccharide linker marque le début de l’élaboration des héparanes sulfate. Cette étape cruciale commence par l’adjonction d’une première hexosamine. Des groupements d’acides aminés acides et/ou hydrophobes près du site d’ancrage Ser-Gly semblent influencer la synthèse des chaînes.
Une fois la première hexosamine ajoutée, l’assemblage des chaînes se poursuit par l’addition séquentielle d’acide glucuronique et d’acide glucuronique N-acétyl glucosamine. Ce procédé est assuré par les enzymes EXT1 et EXT2, formant un hétérodimère avec une double activité glucuronyl- et glucosaminyl-transférase.
La dernière étape engage une série de modifications catalysées par des enzymes telles que les N-déacétylases/N-sulfotransférases. Elles se chargent ensuite d’assurer la désacétylation des glucosamines et la sulfatation des groupements amines libres. Cette étape représente le point de divergence dans les processus de synthèse de l’héparine et des héparanes sulfate.
La voie de son catabolisme implique généralement une internalisation par endocytose, suivie d’une dégradation par l’action combinée d’endoenzymes et d’exoenzymes. Les endoenzymes dépolymérisent d’abord les chaînes en oligosaccharides. Ensuite, les exoenzymes réduisent ces oligosaccharides en monosaccharides et en sulfate inorganique.